
【题目】一种以石墨和过渡金属氧化物做电极材料、以固态有机高聚物做电解质溶剂的锂离子电池,其工作原理如图1所示,图2是合成有机高聚物的单体的结构简式。下列说法中,正确的是

A.放电时,外电路电子由金属氧化物电极流向石墨电极
B.充电时,石墨电极作阳极,过渡金属氧化物作阴极
C.图2所示的两种单体可通过缩聚反应生成有机高聚物溶剂
D.有机高聚物溶剂分子中含醚键和酯基
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJmol-1
CH3OH(g) △H1=-99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:CH3OH结构式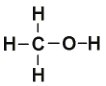
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=____________。
(2)关于反应①下列说法,正确的是____________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:

①从反应开始到5min时,生成甲醇的平均速率为____________。
②H2的平衡转化率α=____________%,化学平衡常数K=____________。
③1min时,υ正____________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正____________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小____________。
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数____________0.1(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
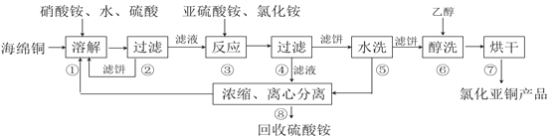
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~70度,原因是__________。
(2)写出步骤③中主要反应的离子方程式___________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________(填字母)
A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
实验操作 | 实验现象 | 结论 | |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 溶液中一定含有SO |
B | 用铂丝蘸取待测液,在酒精灯火焰上灼烧 | 焰色为黄色 | 待测液中肯定不含K+ |
C | 淀粉与稀硫酸的混合液加热后,再加入新制Cu(OH)2,加热 | 无明显现象 | 不能确定淀粉没有发生水解 |
D | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 | 溶液褪色 | 产物不都是烷烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些资料认为NO不能与Na2O2反应,某同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。査阅资料:
a.2NO+Na2O2=2NaNO2;
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;
某同学用如图所示装置(部分夹持装置略),探究NO与Na2O2的反应。
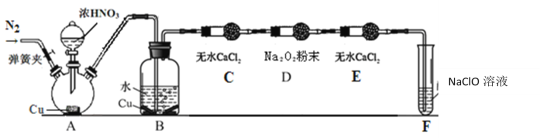
(1)请写出A中反应的化学方程式___。
(2)B中观察到的主要现象是___。
(3)在反应前,打开弹簧夹,通入一段时间N2,目的是___。
(4)充分反应后,检验D装置中发生反应的实验是___。
(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
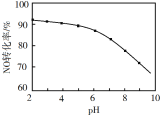
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO![]() ,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有c(CH3COOH)+c(CH3COO-)= 0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是( )
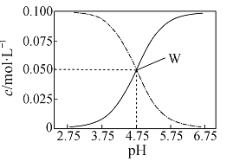
A.pH=5. 5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH =3.5的溶液中:c(CH3COOH) + c(CH3COO-)= c(Na+)
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
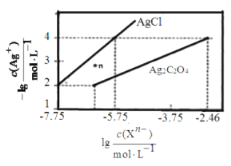
A.n点表示AgCl的不饱和溶液
B.Ksp(Ag2C2O4)的数量级等于10-7
C.Ag2C2O4+2C1-(aq)![]() 2AgCl+C2O42-(aq)的平衡常数为109.04
2AgCl+C2O42-(aq)的平衡常数为109.04
D.向c(C1-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如下反应得到
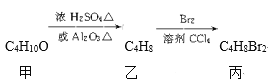
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com