
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
分析 A.晶体中每个Si原子与4个O原子成键,每个O原子与2个Si原子成键,晶体中Si原子与O原子数之比为1:2;
B.氢键存在能够使物质的熔沸点提高;
C.BCl3分子中B原子采用sp2杂化;
D.等电子体所含价电子数相等.
解答 解:A.晶体中每个Si原子与4个O原子成键,每个O原子与2个Si原子成键,故A错误;
B.氨气分子中存在氢键和范德华力,NF3分子间只有范德华力,所以氨气沸点高于NF3,故B正确;
C.NCl3中心原子采用sp3杂化,BCl3分子中B原子采用sp2杂化,故C错误;
D.CO32-的价电子数为22,三氧化硫含电子数为价电子数为24,故D错误;
故选:B.
点评 本题考查了二氧化硅的结构、氢键对物质沸点的影响、原子轨道的杂化方式、等电子体,熟悉相关概念是解题关键,题目难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd互称同位素 | |
| B. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd的原子核内中子数相等 | |
| C. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd的质量数相等 | |
| D. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd含有不同的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
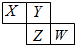 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷与白磷 | B. | 甲烷与乙烷 | C. | ${\;}_{1}^{1}$H与${\;}_{1}^{2}$H | D. | 正丁烷与异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①②⑤ | C. | ③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cd(OH)2 | B. | Ni(OH)2 | C. | NiO(OH) | D. | Cd |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com