
 研究人员发现了一种“水’’电池,其总反应为:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水’’电池,其总反应为:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl--e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1mole-,U型管中消耗0.5mol H2O | |
| D. | 开始时U型管中Y极附近pH逐渐增大 |
分析 X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,Ⅱ为正极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;在原电池中阴离子向负极移动,阳离子向正极移动,以形成闭合电路,以此解答该题.
解答 解:A.X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,Ⅱ为正极,负极发生Ag+Cl--e-=AgCl,故A正确;
B.原电池工作时,阳离子向正极移动,故B错误;
C.每转移1mole-,由2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;
D.Y为阳极,生成氯气,氯气与水反应呈酸性,pH减小,故D错误.
故选A.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3遇少量酸可转化为NaHCO3 | |
| B. | 在水中的溶解度Na2CO3比NaHCO3大 | |
| C. | NaHCO3能与Ca(OH)2溶液反应,而Na2CO3不能 | |
| D. | 与同浓度的盐酸反应时,NaHCO3比Na2CO3剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )| A. | 一定有△H1<0 | B. | 一定有△H2<0 | ||
| C. | 一定有△H1<0,△H2>0 | D. | 一定有△H1+△H2=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
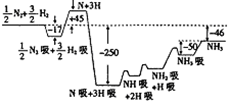 2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
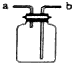 | 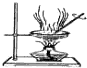 | 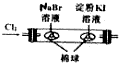 | 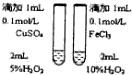 |
| 用该装置排空气法收集H2、CO2、Cl2等气体 | 蒸干AlCl3饱和溶液制备AlCl3晶体 | 可以证明氧化性Cl2>Br2>I2 | 比较不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
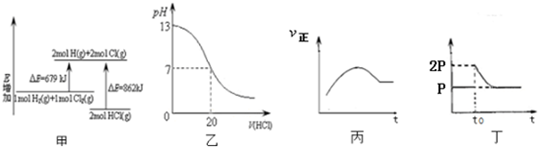
| A. | 图甲表示H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | 图乙表示室温时用0.1 mol/L盐酸滴定20 mL 0.1 mol/LNaOH溶液,溶液pH变化 | |
| C. | 图丙表示向恒容绝热的密闭容器中通入A和B,发生2A (g)+B (g)?2C(g)反应,其正反应速率随时间变化的示意图,则该反应为吸热反应 | |
| D. | 图丁表示在恒温密闭容器中,2BaO2(s)?2BaO(s)+O2(g)达到平衡,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡过程体系压强的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com