
【题目】Ⅰ.为减少碳排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)上述反应常用CuO和ZnO的混合物作催化剂。经研究发现,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率有明显影响。实验数据如表所示:

根据数据表判断,催化剂中CuO的最佳质量分数为________。
(2)已知:①CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
②CO(g)+2H2(g)===CH3OH(g) ΔH2=-91 kJ·mol-1。
写出由CO2和H2制备甲醇蒸气并产生水蒸气的热化学方程式:______________________________。
(3)甲醇是清洁能源。某甲醇燃料电池的电解质为稀硫酸,其能量密度为5.93 kW·h·kg-1。该电池的负极反应式为______________。若甲醇的燃烧热为ΔH=-726.5 kJ·mol-1,该电池的能量利用率为________(结果精确到小数点后1位数字)。(已知1 kW·h=3.6×106 J)
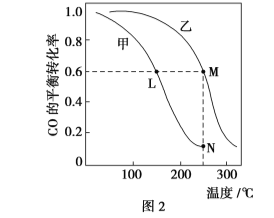
Ⅱ.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
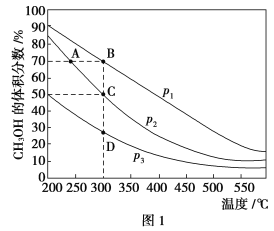
(1)该反应的ΔH________(填“>”、“<”或“=”,后同)0,p1________p2。
(2)达到平衡时,反应速率:A点________B点。平衡常数:C点________D点。
(3)在C点时,CO的转化率为________。
(4)L、M两点容器内压强:p(M)________2p(L)。
【答案】Ⅰ.(1)50%
(2)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1
(3)CH3OH-6e-+H2O===CO2↑+6H+ 94.0%
Ⅱ.(1)< > (2)< = (3)75% (4)>
【解析】Ⅰ.(1)根据数据表知,氧化铜的质量分数为50%时CO2的转化率和CH3OH的产率最高。(2)根据盖斯定律知,②-①得CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1。(3)甲醇在负极上发生氧化反应生成二氧化碳和氢离子。取1 mol甲醇计算:放出总热量Q为726.5 kJ,电池放电能量E=5.93 kW·h·kg-1×0.032 kg×3 600 kJ·(kW·h)-1≈683.1 kJ,该电池的能量利用率为![]() ×100%≈94.0%。
×100%≈94.0%。
Ⅱ.(1)从图示可以看出,随温度升高,平衡混合物中CH3OH的体积分数不断减小,说明该反应为放热反应,ΔH<0;因为该反应是气体体积缩小的反应,图示中从C点到B点,平衡混合物中CH3OH的体积分数增大,反应向正反应方向移动,所以p1>p2。(2)A点与B点相比较,B点压强大、温度高,反应速率快;C点与D点相比较,虽然压强不同,但温度相同,所以平衡常数相同。(3)假设CO的转化率为x,CO、H2的起始物质的量分别为1 mol、2 mol,
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始物质的量: 1 mol 2 mol 0
变化物质的量: x mol 2x mol x mol
平衡物质的量: (1-x)mol (2-2x)mol x mol
根据题意:x mol÷[(1-x)mol+(2-2x)mol+x mol]×100%=50%,x=0.75。
(4)如果不考虑平衡移动,容器乙中气体总物质的量是容器甲中气体总物质的量的两倍,p(M)=2p(L),但现在容器乙温度高,反应又是放热反应,升高温度平衡向逆反应方向移动,气体的物质的量增加,所以p(M)>2p(L)。


科目:高中化学 来源: 题型:
【题目】下列除杂方案正确的是( )
A.氢氧化钠溶液中混有氢氧化钡(硫酸铜溶液)
B.二氧化碳气体中混有氯化氢(氢氧化钠溶液)
C.硝酸铜溶液中混有硝酸银(铜粉)
D.氧化钙中混有碳酸钠(稀盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A. 既不是氧化剂也不是还原剂
B. 是氧化剂
C. 是还原剂
D. 既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下混合液体: ①汽油和氯化钠溶液 ②乙醇与水 ③氯化钠溶液和单质溴,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用2H++ CO32-= H2O + CO2↑表示的是
A. CH3COOH和Na2CO3的反应 B. H2SO4和碳酸氢钠的反应
C. K2CO3和NaHSO4反应 D. 碳酸钙和稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH4NO3中只含共价键
B. 稀有气体分子中不含化学键
C. 干冰升华时,分子内共价键会发生断裂
D. 金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的是
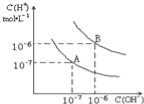
A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L
B.15℃时,pH=7的溶液呈酸性
C.AB连线上的点均表示中性溶液
D.B点对应的温度高于A点对应的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com