
����ӵ���Ѿ���Ϊ��һ��ʵ�û������أ��õ�ؾ��������ܶȴ�ѹ�ߵ����ԣ�����ӵ�طŵ�ʱ�ĵ缫��ӦʽΪ��
������Ӧ��C6Li��xe���TC6Li1��x+xLi+��C6Li��ʾ�ԭ��Ƕ��ʯī�γɵĸ��ϲ��ϣ���
������Ӧ��Li1��xMO2+xLi++xe���TLiMO2��LiMO2��ʾ��﮵Ĺ��ɽ����������
�����й�˵����ȷ���ǣ�������
| �� | A�� | ����ӵ�س��ʱ��ط�ӦΪLiMO2+C6Li1��x�TC6Li+Li1��xMO2 |
| �� | B�� | ��ط�Ӧ�У�ﮡ�п������Ǧ��ʧȥ1 mol ���ӣ�����������ĵ�������� |
| �� | C�� | ����ӵ�طŵ�ʱ����ڲ�Li+���ƶ� |
| �� | D�� | ����ӵ�س��ʱ������ӦΪC6Li1��x+xLi+��xe���TC6Li |
| ԭ��غ͵��صĹ���ԭ���� . | |
| ר�⣺ | �绯ѧר�⣮ |
| ������ | A�����ʱ��ط�ӦʽΪ�ŵ��ط�Ӧʽ�෴�� B������m=nM������������ C���ŵ�ʱ������ڲ��������������ƶ������������ƶ��� D�����ʱ�������ϵõ��ӷ�����ԭ��Ӧ����ŵ�ʱ�����缫��Ӧʽ�෴�� |
| ��� | �⣺A�����ʱ��ط�ӦʽΪ�ŵ��ط�Ӧʽ�෴���ŵ�ʱ��ط�ӦʽΪC6Li+Li1��xMO2=C6Li1��x+LiMO2������ʱ��ط�ӦʽΪC6Li1��x+LiMO2=C6Li+Li1��xMO2����A��ȷ�� B����ط�Ӧ�У�ﮡ�п������Ǧ��ʧȥ1 mol ���ӣ������⼸�ֽ��������ʵ����ֱ���1mol��0.5mol��1mol��0.5mol������m=nM֪�������������ֱ���7g��32.5g��108g��103.5g����������Li������С����B���� C���ŵ�ʱ������ڲ��������������ƶ������������ƶ�������Li+�������ƶ�����C���� D�����ʱ�������ϵõ��ӷ�����ԭ��Ӧ����ŵ�ʱ�����缫��Ӧʽ�෴����缫��ӦʽΪC6Li1��x+xLi++xe���TC6Li����D���� ��ѡA�� |
| ������ | ���⿼��ԭ��غ͵���ԭ������ȷ�������������������������缫��Ӧʽ��ϵ�ǽⱾ��ؼ�����ϵ���ڲ����������ƶ����ɽ����Ŀ�ѶȲ��� |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A+B��X+Y+ H2O(Ϊ��ƽ����Ӧ������ȥ)����ѧ������Ӧ�Ļ�ѧ����ʽ������A��B�����ʵ���֮��Ϊ1��4����ش�
��1����Y�ǻ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2����AΪ�ǽ������ʣ���������ԭ�Ӻ��������������Ǵ�����������2����B����ҺΪijŨ�ᣬ��Ӧ���������뻹ԭ�������ʵ���֮���� ��
��3����AΪ�������ʣ�������A��B��Ũ��Һ�С��ۻ�������A������X��Һ�У�
��AԪ�������ڱ��е�λ����______ �����������ں��壩��Y�Ļ�ѧʽ��______��
�ں�a mol X����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���ԭ��X��______ mol��
��4����A��B��X��Y��Ϊ�����A����ˮ������������Ӻ�ˮ���õ�������ɾ���ˮ����A��Һ�м��������ữ��AgNO3��Һ��������ɫ������B����ɫΪ��ɫ������A����μ���B�����ӷ���ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������ȼ����ڸ߿����������߷������Clԭ�ӣ����������з�Ӧ��Cl+O3��ClO+O2��ClO+O��Cl+O2����˵������ȷ���� ( )
A����Ӧ��O3ת��ΪO2 B��Clԭ�����ܷ�Ӧ�Ĵ���
C�����ȼ������ܷ�Ӧ�Ĵ��� D��Clԭ�ӷ�����ֽ�O3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ�������ж�����ȷ���ǣ�������
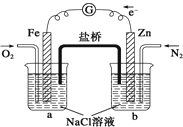
| �� | A�� | �ձ�a�е���ҺH+���� |
| �� | B�� | �ձ�b�з���������Ӧ |
| �� | C�� | �ձ�a�з����ķ�ӦΪ��2H++2e���TH2 |
| �� | D�� | �ձ�b�з����ķ�ӦΪ��2Cl����2e���TCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���칬һ�š���������̫�չ����ڼ������ԴԴ���ϵĵ�Դ��Ӧ���乩��ԭ���ǣ�����̫���ܷ��巢�磬��һ���ֵ���ֱ�ӹ����칬һ�ţ���һ���ֵ��������������������ҹʱʹ�ã������طŵ�ʱ���ܷ�ӦΪ��MH+NiO��OH���TM+Ni��OH��2��MΪ�⻯��缫�Ĵ��������Ҳ�ɿ���H2ֱ�Ӳμӷ�Ӧ��������˵����ȷ���ǣ�������
| �� | A�� | ���ʱ�������������ҺpH��С |
| �� | B�� | ��ʹ�ù����д˵��Ҫ���ϲ���ˮ |
| �� | C�� | �ŵ�ʱNiO��OH���ڵ缫�Ϸ���������Ӧ |
| �� | D�� | ���ʱ������ӦΪNi��OH��2��e��+OH���TNiO��OH��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
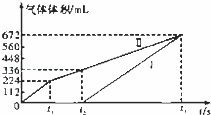
�������ö��Ե缫���200mLһ��Ũ�ȵ�NaCl��CuSO4�����Һ��������������������������ʱ��仯�Ĺ�ϵ��ͼ�Т���ʾ��������������ѻ���ɱ�״���µ������������ͼ����Ϣ�ش��������⣮
��1��ͨ�������Ʋ⣺
��ԭ�����Һ��NaCl��CuSO4�����ʵ���Ũ�ȣ�
c��NaCl��=��0.1��mol•L��1��c��CuSO4��=��0.1��mol•L��1��
��t2ʱ������Һ��pH=��1����
��2�����ö��Ե缫���NaCl��CuSO4�Ļ����Һ200mL������һ��ʱ����������õ�224mL���壬��ԭ�����Һ��������Ũ�ȵ�ȡֵ��ΧΪ��0��c��Cl������0.1mol/L����ͭ����Ũ�ȵ�ȡֵ��ΧΪ��c��Cu2+��=0.05mol/L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
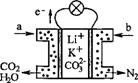 ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʡ���CH4Ϊȼ��ʱ���õ�ع���ԭ������ͼ������˵����ȷ����
ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʡ���CH4Ϊȼ��ʱ���õ�ع���ԭ������ͼ������˵����ȷ����
A��aΪCH4��bΪCO2
B��CO32���������ƶ�
C���˵���ڳ���ʱҲ�ܹ���
D�������缫��ӦʽΪ��O2+2CO2+4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ�����ù�̬�����Ȼ��ƣ�������NH4HCO3��Na2SO4���ʣ���ȡ�����Ȼ�����Һ�����в����ɹ�ѡ�ã�
����μ���ϡ���ᣬ����pHֵΪ5��
�����
�ۼ�����ˮ�ܽ⣻
�ܼ��������ٲ�������Ϊֹ��
�ݼ����Թ�����Na2CO3��Һ��
�����Թ�����BaCl2��Һ��
�߹��ˣ�
����ʵ���������ȷ˳��Ӧ�ǣ�������
| �� | A�� | �٢ڢݢޢߢۢ� | B�� | �ۢܢޢݢߢ٢� | C�� | �ܢۢޢݢߢ٢� | D�� | �ܢۢݢޢߢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ݿ�֤���̴���ͭ����Ҫ����ԭ���ǿ�ȸʯ����Ҫȼ����ľ̿��ұ���¶ȹ�����1000 �����ң������漰�ķ�Ӧ�У���Cu2(OH)2CO3 2CuO��CO2����H2O
2CuO��CO2����H2O
��2CuO��C 2Cu��CO2��
2Cu��CO2��
��CuO��CO Cu��CO2
Cu��CO2
��CO2��C 2CO
2CO
(1)�����ֻ�����Ӧ���Ϳ����٢ڢֱܷ�����________��________��________��
(2)��������Ӧ�У�����������ԭ��Ӧ����__________(�����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com