
常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.
(1)通过计算推测:
①原混合溶液中NaCl和CuSO4的物质的量浓度.
c(NaCl)= 0.1 mol•L﹣1,c(CuSO4)= 0.1 mol•L﹣1.
②t2时所得溶液的pH= 1 .
(2)若用惰性电极电解NaCl和CuSO4的混合溶液200mL,经过一段时间后两极均得到224mL气体,则原混合溶液中氯离子浓度的取值范围为 0<c(Cl﹣)<0.1mol/L ,铜离子浓度的取值范围为 c(Cu2+)=0.05mol/L .
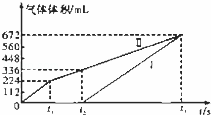
| 电解原理. . | |
| 专题: | 电化学专题. |
| 分析: | 本题的关健是对图象的解读.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl﹣放电,反应完后溶液中的OH﹣放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl﹣﹣2e﹣=Cl2↑、4OH﹣﹣4e﹣=O2↑+2H2O,阴极发生Cu2++2e﹣=Cu、2H++2e﹣=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒. |
| 解答: | 解:(1)电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl﹣﹣2e﹣=Cl2↑、4OH﹣﹣4e﹣=O2↑+2H2O,阴极发生Cu2++2e﹣=Cu、2H++2e﹣=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系, ①由图可知,产生氯气为224mL,则由2Cl﹣﹣2e﹣=Cl2↑可知,n(NaCl)= Ⅱ曲线中由t2时生成氧气为112mL,n(O2)= 根据电子守恒及Cu2++2e﹣=Cu可知,n(CuSO4)= 故答案为:0.1;0.1; ②由t2时4OH﹣﹣4e﹣=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)= 故答案为:1; (2)根据题意,在阴极放电的离子有Cu2+、H+,在阳极放电的离子有Cl﹣、OH﹣,经过一段时间后两极分别得到224mL气体,设c(Cl﹣)=x,c(Cu2+)=y. 阴极反应:Cu2++2e﹣=Cu 0.2y 0.4y 2H++2e﹣=H2↑ 0.02mol 阳极反应: 2Cl﹣﹣2e﹣=Cl2 0.2x 0.2x 0.1x 4OH﹣﹣4e﹣=2H2O+O2 0.04mol﹣0.2x 因为阳极生成的气体不可能全为O2, 所以0<0.01﹣0.1x<0.01,0<x<0.1, 又根据阴阳两极通过电子数相等得:0.4y+0.02=0.2x+0.04﹣0.2x,即0.4y+0.02=0.04y+0.02=0.2x+0.04,即0y=0.05mol/L 故答案为:0<c(Cl﹣)<0.1mol/L;c(Cu2+)=0.05mol/L. |
| 点评: | 本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意把握电极反应式的书写,为解该题的关键,题目难度中等. |


科目:高中化学 来源: 题型:
1.化学与生活密切相关,下列说法正确的是( )
A. 二氧化硫可广泛用于食品的漂白
B. 煤经过气化和液化等物理变化可以转化为清洁燃料
C. 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应
D. 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( )
|
| A. | HCl | B. | MgSO4 | C. | CuSO4 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
负极反应:C6Li﹣xe﹣═C6Li1﹣x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1﹣xMO2+xLi++xe﹣═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
|
| A. | 锂离子电池充电时电池反应为LiMO2+C6Li1﹣x═C6Li+Li1﹣xMO2 |
|
| B. | 电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大 |
|
| C. | 锂离子电池放电时电池内部Li+向负极移动 |
|
| D. | 锂离子电池充电时阴极反应为C6Li1﹣x+xLi+﹣xe﹣═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.Al-Mg合金焊接过程中使用的保护气为N2
B.工业上可采用电解熔融NaCl的方法制备金属钠
C.将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,则该热化学方程式为N2(g) + 3 H2(g) 2NH3(g);△H= — 39.2 KJ·mol-1
 D.已知:2H2(g) + O2(g) ===2H2O(g) ;△H= — 486 KJ·mol-1 ,则H2 的燃烧热为243 KJ·mol-1
D.已知:2H2(g) + O2(g) ===2H2O(g) ;△H= — 486 KJ·mol-1 ,则H2 的燃烧热为243 KJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下述对焰色反应实验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替.
A.仅有③不正确 B.仅有④不正确 C.仅有⑤不正确 D.全正确
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:11P4(白磷)+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,若有9 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为( )
|
| A. | mol | B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
将饱和FeCl3溶液滴入沸水中,液体变为________色,得到的是_________,用此分散系进行下列实验:
⑴将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色________,这说明________________,这种现象称为____________
⑵向其中加入饱和(NH4)2SO4溶液发生的现象是______________,原因是______________
⑶向其中滴入过量稀硫酸,现象是__________________________________________,其原因是______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com