
下面是对日常生活中常见的一些做法的解释或现象的描述,其中正确的是
①生产面粉的工厂车间应“严禁烟火”:面粉颗粒很小,悬浮在空气中的单位质量的面粉与O2的接触面积大,遇到明火易发生爆炸
②使用冰箱贮存食物可延长食物保鲜期:冰箱内气温较低,微生物的生长、繁殖速率慢
③镀锡铁桶在镀层破损后破损处很快会出现破洞
④铝比铁性质活泼得多,但铝制品比铁制品耐腐蚀得多:铝表面能形成致密的氧化物保护膜
⑤用酒精擦拭皮肤后,相应部位有清凉感:酒精具有消毒杀菌能力
A.①②③④⑤ B.①②③④ C.①②④ D.③④⑤
科目:高中化学 来源: 题型:
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20=NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
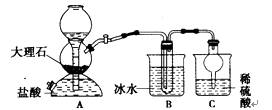
(1)A装置中所发生反应的离子方程式为 .
C装置中稀硫酸的作用为
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
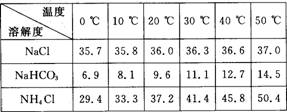
参照表中数据,请分析B装置中使用冰水的目的是
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出
应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
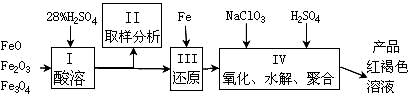
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42ˉ与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42ˉ与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂质的方法不可行的是
A 用过量氨水除去Al3+溶液中的少量Fe3+
B 将混合气体通过灼热的铜网除去N2中少量O2
C 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D 用盐酸除去AgCl中少量的Ag2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电化学的实验事实正确的是
|
| 出现环境 | 实验事实 |
| A. | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B. | 电解CuCl2溶液 |
|
| C. | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D. | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精 溶液具有的性质是 。
溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液 ,产生白色沉淀。则沉淀X中含有的物质是 。
,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
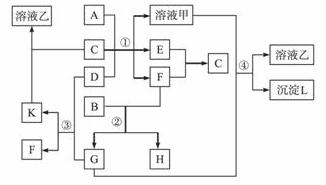
(1)A、B、C、D代表的物质分别为__________、__________、__________、__________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是______________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为____________________;
(5)反应④的离子方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com