
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

【答案】3d104s2 O>Cl V形 sp3 ClO3- SO32- 分子 分子间作用力(范德华力)和共价键 CaTiO3 ![]()
【解析】
A、B、C为金属且同周期,原子序数A<B<C, A、C核外均没有未成对电子;可知A、B、C为第四周期元素;B原子核外有二个未成对电子和三个空轨道,说明B的价电子排布为3d24s2,为Ti,则A为4S2为Ca,C为3d104s2,为Zn。D原子最外层电子数是其周期序数的三倍,D为O。E能与D形成化合物ED2,可用于自来水的消毒,E为Cl。
(1)C的基态原子的价层电子排布式为3d104s2;由E能与D形成化合物ED2,知电负性O>Cl
(2)化合物E2D中中心原子O的杂化类型为sp3,分子的空间构型为折线型; O与Cl形成三角锥结构的阴离子的化学式为ClO3-,它的等电子体有SO32-等。
(3)根据熔点:-25℃,沸点:l 36.4℃。则该化合物属于分子晶体,晶体内含有的作用力类型有分子间作用力和分子内的共价键
(4)根据A、B、D三种元素形成的某晶体的晶胞结构可知,一个晶胞中含有一个Ca一个Ti和三个O,因此化学式为CaTiO3;最近的B与D的原子距离为a cm,则立方体的边长为![]() acm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,设该晶体的密度为xg/cm3。(
acm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,设该晶体的密度为xg/cm3。(![]() a)3·NA·x=M,解得:x=
a)3·NA·x=M,解得:x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】碳元素以C—C键构成了有机界,硅元素以![]() 键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
(1)基态锗(![]() )原子的核外电子排布式为
)原子的核外电子排布式为![]() _____;
_____;![]() 分子空间构型是__________。
分子空间构型是__________。
(2)![]() 发生水解的机理如图:
发生水解的机理如图:

![]() 不能按照上述机理发生水解反应,原因是____________________。
不能按照上述机理发生水解反应,原因是____________________。
(3)金刚石熔点为4440℃,晶体硅熔点为1410℃,金刚石熔点比晶体硅高的原因是_______。
(4)C和![]() 经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
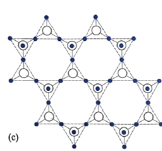
(5)在硅酸盐中,![]() 四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中
四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中![]() 原子的杂化方式为______,化学式为_______。
原子的杂化方式为______,化学式为_______。


(6)铝硅酸盐分子筛在化工领域有重要的应用。铝硅酸盐结构中![]() 价铝部分地置换
价铝部分地置换![]() 四面体结构中
四面体结构中![]() 价的硅。从结构角度分析
价的硅。从结构角度分析![]() 价铝能够置换
价铝能够置换![]() 价硅的原因是_________。
价硅的原因是_________。
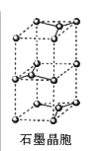
(7)石墨采取六方最密堆积方式,晶胞结构如图。晶胞参数为底边长![]() ,高
,高![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则石墨晶体的密度为_______
,则石墨晶体的密度为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
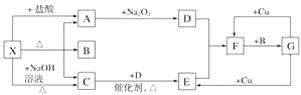
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国对二氧化硫一空气质子交换膜燃料电池的研究处于世界前沿水平,该电池可实现硫酸生产、发电和环境保护三位一体的结合。其原理如图所示。下列说法不正确的( )
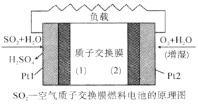
A.Pt1电极附近发生的反应为:SO2 + 2H2O-2e- = SO42-+4H+
B.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
C.该电池工作时质子从Pt2电极经过内电路流到Pt1电极
D.该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.8g表面被氧化的金属钠投入到足量的水中得到溶液200mL,并生成2.24L的气体(标准状况下)。往得到的溶液中通入一定量的CO2气体,充分反应后将溶液低温蒸干,得到固体27.4g。求:
(1)原金属中单质钠的质量分数(保留一位小数)___;
(2)所得200mL溶液的物质的量浓度___;
(3)通入的CO2在标准状况下的体积___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断下列说法中错误的是

A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:

(1)贝壳主要成分的化学式是__。
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:__,基本反应类型是__。
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:__,该反应基本类型是__。
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:___,反应基本类型是__。
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到__。
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下自然界存在如下反应:14CuSO4+5FeS2+l2H2O=7Cu2S+5FeSO4+12H2SO4,下列说法中不正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有21mole—转移
C.CuSO4和FeS2是氧化剂,FeS2是还原剂
D.产物中的SO42—有一部分是氧化产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com