
| A、NA个氧分子和NA和氢分子的质量比为8:1 |
| B、11.2L氢气中含有的原子数为NA个 |
| C、54g水中含有分子数为3NA个 |
| D、1mol/L硫酸钠溶液中硫酸根离子离子数为NA |
| m |
| M |
| N |
| NA |
| m |
| M |
| N |
| NA |
| m |
| M |
| N |
| NA |
| m |
| M |
| 54g |
| 18g/mol |
| N |
| NA |


科目:高中化学 来源: 题型:
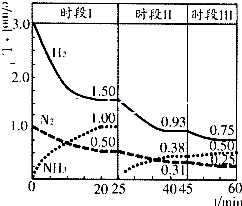 N2(g)+3H2(g)?2NH3(g)△H=-92.2kJmol-1.在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示.下列说法错误的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.2kJmol-1.在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示.下列说法错误的是( )| A、前25min内反应放出的热量为46.1kJ |
| B、第25min改变的条件是将NH3从反应体系中分离出去 |
| C、若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D、若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL 0.3mol?L-1 Na2CO3 |
| B、10mL 0.4mol?L-1 Na2CO3 |
| C、25mL 0.4mol?L-1 Na2CO3 |
| D、15mL 0.5mol?L-1 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐析法分离氯化钠溶液和淀粉胶体 |
| B、乙醇脱水制备乙烯的实验中,可选用浓硫酸或P2O5作反应的催化剂 |
| C、味精是常见的家用调味品,其主要成分是谷氨酸钠.谷氨酸是一种氨基酸,与双缩脲试剂呈现紫玫瑰色 |
| D、用碱式滴定管量取一定量的氢氧化钠溶液,需先用该NaOH溶液润洗3次,然后加入NaOH溶液,排除橡皮管中的气泡后,注意调节液面需位于“0”刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
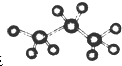
 与C8H6互为同分异构体.
与C8H6互为同分异构体.| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
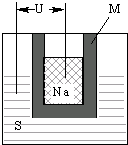 美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )
美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )| A、M只是用来隔离Na和S |
| B、正极的电极反应式为xS+2e?→Sx2? |
| C、与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4倍 |
| D、Na+在电池工作过程中朝负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将水杨酸、乙酸酐和浓硫酸在锥形瓶中混合后,85-90℃水浴加热5-10min,取出锥形瓶,置于冰水浴中,使阿司匹林结晶析出,为了使其结晶完全需要向锥形瓶中继续加适量的水 |
| B、用移液管取液后,将移液管稍倾斜放入锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| C、相同条件下,10mL 0.1mol/L FeCl2溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色由浅绿色变成黄色,10mL 0.1mol/L KI溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色无变化,说明溶液的pH会影响NO2-的氧化性 |
| D、为了检验火柴头中的硫元素,先用刀片削下几根火柴的火柴头,放入一支中号试管中,先用酒精灯加热该试管底部引燃“火药”,然后塞上橡皮塞待用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
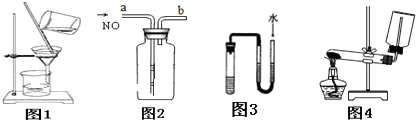
| A、分离乙醇和乙酸乙酯的混合物 |
| B、用图2装置收集一瓶纯净的NO |
| C、用图3装置中U型管两端有液面差且保持不变时证明装置不漏气 |
| D、用图4装置制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 操作及现象 | 结论 |
| A | 将0.1mol?L-1氨水稀释成0.01mol?L-1,测得pH由11.1变成10.6 | 稀释后NH3?H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com