
【题目】常用的食品抗氧化剂BHT的合成方法如下图所示(假设原料均能恰好完全反应):

下列说法中不正确的是( )
A.方法一的原子利用率为100%
B.方法二属于取代反应
C.X与Y均能与![]() 、
、![]() 溶液、溴水发生反应
溶液、溴水发生反应
D.![]() 在稀
在稀![]() 条件下发生消去反应可生成
条件下发生消去反应可生成![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图,矩形OABC中,OA、OC分别在平面直角坐标系x轴、y轴的正半轴上,点D在AB上,将△CDB沿着CD翻折,点B恰好落在OA的中点E处,若四边形OCDA的面积为![]() ,则直线ED的解析式为( )
,则直线ED的解析式为( )
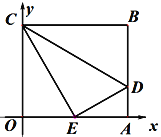
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用冶铅废渣(含Pb、PbO、PbS及Zn、Fe、Cu等杂质)制取立德粉和回收铅的工艺流程如下:
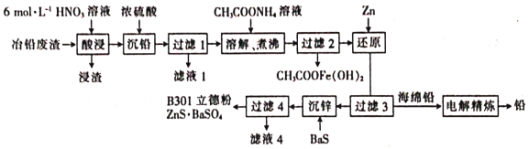
(1)“酸浸”时,PbS被氧化生成S,硝酸被还原为NO,则氧化0.3 mol PbS时,消耗HNO3______mol。
(2)“溶解、煮沸”时会发生多个反应。
①PbSO4溶解的离子方程式为__________________。(已知:Pb(CH3COO)2是弱电解质)
②“沉铅”时生成的沉淀中混有Fe3+,煮沸时醋酸铁水解的化学方程式为__________________。
(3)海绵铅(含少量Zn、Cu等杂质)进行“电解精炼”时,用PbSiF6、H2SiF6的混合溶液作电解液,海绵铅作_____(填“阳”或“阴”)极,阳极泥的主要成分是______(填化学式)。
(4)B301立德粉(ZnS·BaSO4)中ZnS的理论含量为29.4%。
①若要生产ZnS的理论含量为62.5%的B311高ZnS立德粉,可用的原料除BaS外,另两种原料可能为______。(填标号)
A. ZnSO4 B.NaCl C. ZnCl2 D. Na2SO4
②测定立德粉中ZnS的含量常用酸溶,调节pH至1~3,然后滴定形成K2Zn3[Fe(CN)6]2沉淀,该沉淀的溶度积常数Ksp的表达式为______。
(5)滤液4经加热后可返回______工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a制备,b会发生较多的副反应.回答下列问题:
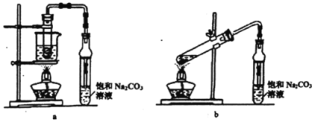
(1)实验时,通常加入过量的乙醇,原因是_____。
(2)饱和Na2CO3溶液的作用是_____。
(3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中,_____、_____,然后分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Calanolide A是一种抗HIV药物,其结构简式如下图所示。已知:碳原子上连有4个不同的原子或基团时,该碳称为手性碳。下列关于Calanolide A的说法不正确的是( )
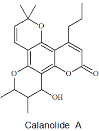
A.分子中有3个手性碳原子
B.分子中有5种含氧官能团
C.能发生消去反应、加成反应、氧化反应和还原反应
D.1molCalanolide A最多消耗2molNaOH或5molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
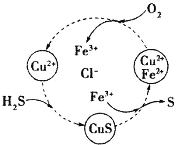
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是原子序数依次增大的短周期主族元素。基态b原子s轨道上的电子总数是基态a原子s轨道上的电子总数的4倍,基态c原子p轨道上的电子数比基态b原子p轨道上的电子数多1,b的原子序数等于d的原子序数的一半,d的最高正价与最低负价的代数和为0。下列说法正确的是( )
A.基态a原子最外层电子排布为![]()
B.最简单氢化物的热稳定性:b>d
C.![]() 中
中![]() 键与
键与![]() 键的数目之比为
键的数目之比为![]()
D.c与其他三种元素形成的二元化合物中,c的化合价一定为-2价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com