
����Ŀ��a��b��c��d��ԭ��������������Ķ���������Ԫ�ء���̬bԭ��s����ϵĵ��������ǻ�̬aԭ��s����ϵĵ���������4������̬cԭ��p����ϵĵ������Ȼ�̬bԭ��p����ϵĵ�������1��b��ԭ����������d��ԭ��������һ�룬d���������������۵Ĵ�����Ϊ0������˵����ȷ���ǣ� ��
A.��̬aԭ�����������Ų�Ϊ![]()
B.����⻯������ȶ��ԣ��⣾��
C.![]() ��
��![]() ����
����![]() ������Ŀ֮��Ϊ
������Ŀ֮��Ϊ![]()
D.c����������Ԫ���γɵĶ�Ԫ�������У�c�Ļ��ϼ�һ��Ϊ-2��
���𰸡�BC
��������
a��b��c��d��ԭ��������������Ķ���������Ԫ�ء�d���������������۵Ĵ�����Ϊ0��dΪSiԪ�أ�b��ԭ����������d��ԭ��������һ�룬bΪNԪ�أ���̬cԭ��p����ϵĵ������Ȼ�̬bԭ��p����ϵĵ�������1��cΪOԪ�أ���̬bԭ��s����ϵĵ��������ǻ�̬aԭ��s����ϵĵ���������4����aΪHԪ�ء�
A��aΪHԭ�ӣ���̬aԭ�����������Ų�Ϊ![]() ����A����
����A����
B���ǽ����ԣ�N��Si������⻯������ȶ��ԣ�NH3��SiH4����B��ȷ��
C��![]() ��������
��������![]() ����
����![]() ������Ŀ֮��Ϊ
������Ŀ֮��Ϊ![]() ����C��ȷ��
����C��ȷ��
D��H2O2������-1�ۣ���D����
��ѡBC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�ʳƷ��������BHT�ĺϳɷ�������ͼ��ʾ(����ԭ�Ͼ���ǡ����ȫ��Ӧ)��

����˵��������ȷ����( )
A.����һ��ԭ��������Ϊ100%
B.����������ȡ����Ӧ
C.X��Y������![]() ��
��![]() ��Һ����ˮ������Ӧ
��Һ����ˮ������Ӧ
D.![]() ��ϡ
��ϡ![]() �����·�����ȥ��Ӧ������
�����·�����ȥ��Ӧ������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɳ�����������Ե�֧�����������ã��ٴ�����Ҫ�������ƴ�Ϣ��֧�����ס�֧���������ȣ�����һ��ͨ�õĺϳ�·�����£�
��֪��![]()
��������ϳ�·�ߣ���ش�
(1)����˵������ȷ����________ ��
A��ɳ�������ķ���ʽΪ![]()
B�����![]() �Ĺ�����Ϊ�˱������еĹ�����
�Ĺ�����Ϊ�˱������еĹ�����
C��![]() �Ĺ����л�ԭ��Ӧ����
�Ĺ����л�ԭ��Ӧ����
D��������![]() ���Է����ķ�Ӧ�����мӳɡ���ȥ����ԭ��
���Է����ķ�Ӧ�����мӳɡ���ȥ����ԭ��
(2)������![]() �Ľṹ��ʽΪ________________��
�Ľṹ��ʽΪ________________��
(3)��д��![]() ���̵Ļ�ѧ��Ӧ����ʽ��__________��
���̵Ļ�ѧ��Ӧ����ʽ��__________��
(4)д��ͬʱ�������������Ļ�����![]() ���е�ͬ���칹��________________��
���е�ͬ���칹��________________��
�ٷ����к���������![]() ��Һ����ɫ�����ܷ���������Ӧ���۷�������4�ֲ�ͬ��ѧ������
��Һ����ɫ�����ܷ���������Ӧ���۷�������4�ֲ�ͬ��ѧ������![]() ԭ��
ԭ��
(5)��������ѧ֪ʶ�������漰�ķ�Ӧ������Ա�����ȩ���춡ϩ![]() Ϊԭ�Ϻϳɻ�����
Ϊԭ�Ϻϳɻ�����![]() ��·��(������ͼ��ʾ�����Լ���ѡ)_________��
��·��(������ͼ��ʾ�����Լ���ѡ)_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������4����Ҫ���л��
�� ��
�� ��
�� ��
��![]()
��ش�
(1)���뱽�����ϳɸ߷��ӻ��������__________��(�����)��
(2)��ʹ���Ը��������Һ��ɫ����__________��(�����)��
(3)д������һ�������·�����ȥ��Ӧ�Ļ�ѧ����ʽ__________��
����2020��3��22��Ϊ��28������ˮ�գ���ѧ���кܶ���ˮ��صĻ�ѧ֪ʶ��
(1)��ˮ�ḯʴ���ʺ�����ǣ����캣��ʱ���ڴ���������Ƕ_____��(����п��������ͭ����)
(2)����ˮ�����ú���Fe3+�ľ�ˮ����ˮ����ԭ����______��(�����ӷ���ʽ��ʾ)
(3)����ˮ��������ɱ��������Cl2��H2OHCl��HClO��Ҫ����HClO��Ũ�ȣ����Լ������������е�__________��
A��NaOH B��ŨHCl C��CaCO3���� D��H2O E��SO2
(4)�����£�0.01mol��L-1NaOH��Һ����ˮ�������c(OH)��______mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
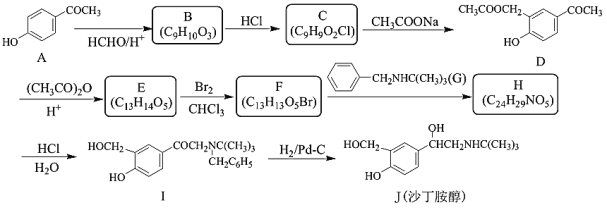
����Ŀ������«��Τ���ǿ�������״����DZ����ҩ��������M�����ĺϳ��м��壬��ϳ�·�����£�
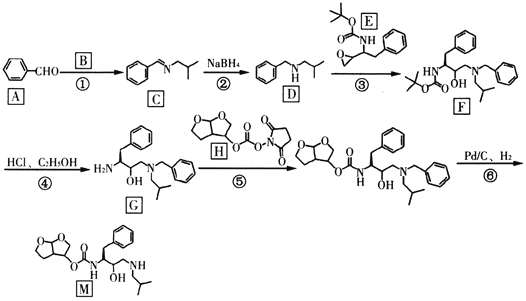
��֪��R1CHO![]()
![]()
�ش��������⣺
(1)�л���A��������______________����Ӧ�ڷ�Ӧ������__________��
(2)����B�Ľṹ��ʽ��____________��E�ķ���ʽΪ_____________��
(3)G�к��������ŵ�������________��F����________������̼ԭ�ӡ�
(4)��д����Ӧ�ݵĻ�ѧ��Ӧ����ʽ_____________��
(5)����N��C��һ��ͬ���칹�壬д����������������һ��ͬ���칹��Ľṹ��ʽ_______��
�ٷ��ӽṹ�к��б����Ͱ����������뱽��ֱ������������ʹ��ˮ��ɫ���ۺ˴Ź���������6��壬�����֮��Ϊ6��3��2��2��1��1��
(6)����ɱ��״���CH3NH2Ϊԭ���Ʊ�![]() �ĺϳ�·��_______________��
�ĺϳ�·��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����Ҫ�Ľ�Ѫ��ҩ��M��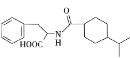 ���ĺϳ�·�����£���ȥ���ַ�Ӧ��������
���ĺϳ�·�����£���ȥ���ַ�Ӧ��������
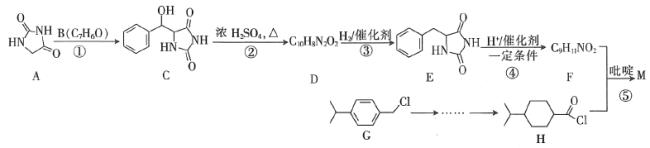
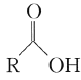
��֪��
![]()
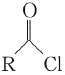
�ش��������⣺
��1��B������Ϊ________��F�Ľṹ��ʽΪ________��
��2����Ӧ�ڵķ�Ӧ����Ϊ________��
��3�����й��������漰���л����˵����ȷ����________�����ţ���
a.������E��ʹ���Ը��������Һ��ɫ
b.������F���������ᷴӦ��������![]() ��Һ��Ӧ
��Һ��Ӧ
c.M�к��������ŵ�����Ϊ������ͪ��
��4��д��![]() �Ļ�ѧ����ʽ��________��
�Ļ�ѧ����ʽ��________��
��5����G���Ƶ�����I��![]() ����д����������������I��ͬ���칹��Ľṹ��ʽ��________��
����д����������������I��ͬ���칹��Ľṹ��ʽ��________��
������![]() ��Һ������ɫ��Ӧ
��Һ������ɫ��Ӧ
�ڳ������ⲻ��������
��![]() ���з����֮��Ϊ
���з����֮��Ϊ![]()
��6���������GΪԭ�Ϻϳ�H�ĺ���·������ͼ�����Լ���ѡ����_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A. 298 Kʱ��2H2S(g)��SO2(g)===3S(s)��2H2O(l)���Է����У�������H��0
B. ��ˮϡ�ͺ���Һ��c(NH4��)/c(NH3��H2O)��ֵ��С
C. ��⾫��ͭ�����У����������ļ�������������������һ�����
D. 25��ʱKa(HClO)��3.0��108��Ka(HCN)��4.9��1010�������¶���NaClO��Һ��NaCN��Һ��pH��ͬ����c(NaClO)��c(NaCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ�������Ϊ2 L�ĺ����ܱ������м����������ۺ�0.08 mol H2O(g)��������Ӧ3Fe(s)��4H2O(g)![]() Fe3O4(s)��4H2(g)��һ��ʱ����ƽ�⡣t1ʱ�����������ٳ���һ������H2���ٴδ�ƽ��ʱH2���������Ϊ20%������˵����ȷ����(����)
Fe3O4(s)��4H2(g)��һ��ʱ����ƽ�⡣t1ʱ�����������ٳ���һ������H2���ٴδ�ƽ��ʱH2���������Ϊ20%������˵����ȷ����(����)
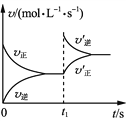
A. t1ʱ�̳���H2��v������v�����仯����ͼ
B. ��һ�δ�ƽ��ʱ��H2���������С��20%
C. �¶�ΪTʱ����ʼ��ԭ�����г���0.1 mol���ۡ�0.04 mol H2O(g)��0.1 mol Fe3O4(s)��0.005 mol H2(g)����Ӧ������Ӧ�������
D. �¶�ΪTʱ�����ѹ�����м�������Fe3O4(s)��0.08 mol H2 (g)����ƽ��ʱH2(g)ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���һˮ�ϰ�����Ҫ���������������£�����볣�����±���ʾ���ش��������⣺
������� | H2CO3 | NH3��H2O | |
���볣�� |
|
|
|
(1)̼���һ�����뷽��ʽΪ______���������볣������ʽ![]() ________��
________��
(2)Ũ�Ⱦ�Ϊ0.01 mol.L-1��H2CO3��Һ��NH3��H2O��Һ�������ϣ������Һ�е�������_______(д��ѧʽ)�������Һ��![]() ��
��![]() ��
��![]() ��
��![]() ��Ũ���ɴ�С��˳����_______��
��Ũ���ɴ�С��˳����_______��
(3)![]() ��
��![]() ��ˮ��Һ����ٽ�ˮ�⣬��ӦΪ
��ˮ��Һ����ٽ�ˮ�⣬��ӦΪ![]() �������£��÷�Ӧ��ƽ�ⳣ��
�������£��÷�Ӧ��ƽ�ⳣ��![]() _______��(����2λ��Ч����)��
_______��(����2λ��Ч����)��
(4)�����£���100 mL 0.2 mol.L-1NaHCO3��Һ�м���100 mL 0.2 mol��L-1NH3��H2O��Һ����![]() +____+_____��
+____+_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com