
【题目】现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答 下列问题:
(1)写出下列物质的化学式: A____B________ F_____ 丙______
(2)写出下列反应离子方程式:
反应③__________________________________________
反应⑤_________________________________________
反应⑥_________________________________________
【答案】 Na Al FeCl2 HCl 2Al + 2H2O + 2OH- == 2AlO2-+3 H2↑ 2Fe2+ + Cl2 == 2Fe3+ +2Cl- Fe3++ 3OH- == Fe(OH)3↓
【解析】金属A的焰色反应显黄色,A是Na,与水反应生成氢氧化钠和氢气,甲是氢气,D是氢氧化钠,金属B与氢氧化钠反应生成氢气,则B是Al。黄绿色气体乙是氯气,与氢气反应生成丙是氯化氢,溶于水得到盐酸。红褐色沉淀是氢氧化铁,则G是氯化铁,F与氯气反应生成G,则F是氯化亚铁,所以金属C是铁。
(1)根据以上分析可知A是Na,B是Al,F是FeCl2,丙是HCl;(2)根据以上分析可知反应③的方程式为2Al+2H2O+2OH- ==2AlO2-+3H2↑;反应⑤的方程式为2Fe2++Cl2==2Fe3++2Cl-;反应⑥的方程式为Fe3++3OH-==Fe(OH)3↓。


科目:高中化学 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。
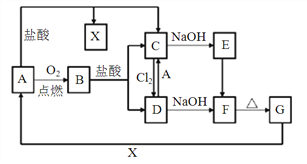
(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
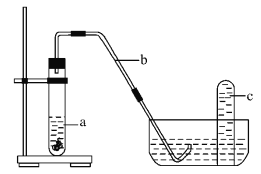
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。
点睛:本题考查了一定物质的量浓度溶液的配制及硝酸性质探究,明确配制原理及操作步骤,熟悉硝酸的性质是解题关键,易错点为(4)①铜与硝酸反应生成硝酸铜,硝酸铜为蓝色溶液;②依据一氧化氮能够与空气中氧气反应生成二氧化氮解答;③依据二氧化氮能够与水反应生成硝酸和一氧化氮解答。
【题型】综合题
【结束】
29
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是( )
①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A.①⑥
B.④⑤
C.①④
D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
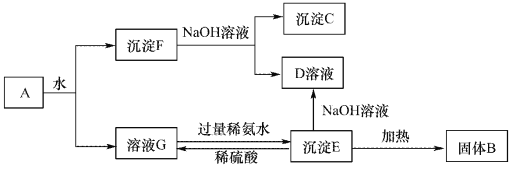
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
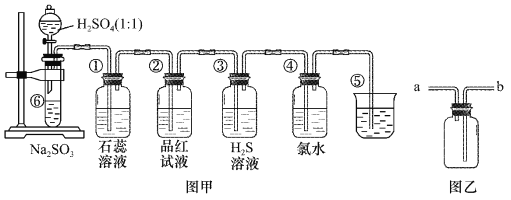
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ___________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(s)+nB(g)qC(g);△H<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如图所示,下列叙述正确的是( ) 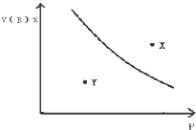
A.m+n<q
B.n<q
C.X点时的状态,V正>V逆
D.X点比Y点混和物的正反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于__________氧化物(填“酸性”“碱性”或“两性”)。盛装NaOH 等碱性溶液的试剂瓶不能用玻璃塞,其原因可用离子方程式表示为____________________________。
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
①据SiO2中Si元素的价态可推知SiO2_____________(填字母):
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
②工业上用石英砂和焦炭混合高温制取粗硅,其反应为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
用双线桥法标出电子转移方向与数目:____________________________。
(3)从其它角度认识可能具有的特性。
SiO2能与唯一的酸____________ (填物质名称或化学式)反应,工艺上常利用该反应___________(填一种用途)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是( )
A. 硝酸、苏打、石灰石 B. 硅酸、纯碱、食盐
C. 盐酸、乙醇、氯化钠 D. 硫酸、烧碱、小苏打
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com