
| A. | 还原Fe粉 | B. | FeO | C. | Fe3O4 | D. | Fe2O3 |
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
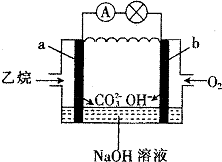
| A. | a为负极,电极反应式为CH3CH3-14e-+18OH-═2CO32-+12H2O | |
| B. | 电子从a极经导线移向b极,再经溶液移向a极 | |
| C. | 电池工作一段时间后电解质溶液的pH增大 | |
| D. | 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
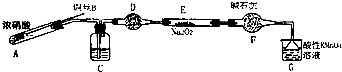 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
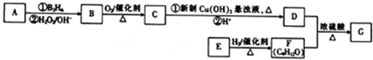
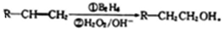
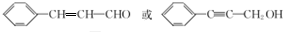 .
.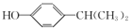 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
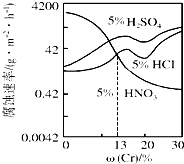 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
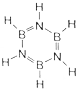 氮元素是一种常见元素,能形成多种化合物.
氮元素是一种常见元素,能形成多种化合物.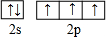 ,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.
,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.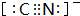 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com