
ЁОЬтФПЁПАЂЗќМгЕТТоГЃЪ§ЕФжЕгУ NA БэЪОЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.33.6L БћЯЉ(БъзМзДПі)гызуСП HCl ЗЂЩњМгГЩЗДгІЃЌЩњГЩ 1-ТШБћЭщИіЪ§ЮЊ1.5NA
B.14g ЗжзгЪНЮЊCnH2n ЕФСДЬўжаКЌгаЕФCЁЊH МќЕФЪ§ФПЮЊ NA
C.2mol БљДзЫсгы 4mol ввДМвЛЖЈЬѕМўЯТГфЗжЗДгІЃЌЩњГЩввЫсввѕЅИіЪ§ЮЊ 2NA
D.1L lmol/L ЕФЦЯЬбЬЧШмвКжаЃЌШмжЪЫљКЌєЧЛљЕФИіЪ§ЮЊ 5NA
ЁОД№АИЁПD
ЁОНтЮіЁП
AЃЎБћЯЉгыHClМгГЩПЩвдЩњГЩ1-ТШБћЭщЃЌвВПЩвдЩњГЩ2-ТШБћЭщЃЌЫљвд33.6LБћЯЉ(БъзМзДПі)гызуСПHClЗЂЩњМгГЩЗДгІЃЌЩњГЩ1-ТШБћЭщИіЪ§аЁгк1.5NAЃЌAДэЮѓЃЛ
BЃЎ14gЗжзгЪНЮЊCnH2nЕФСДЬўжаКЌгаЕФCЁЊHМќЕФЮяжЪЕФСПЪЧ![]() ЃЌЪ§ФПЮЊ2NAЃЌBДэЮѓЃЛ
ЃЌЪ§ФПЮЊ2NAЃЌBДэЮѓЃЛ
CЃЎ2molБљДзЫсгы4molввДМЗЂЩњЕФЪЧѕЅЛЏЗДгІЃЌЖјѕЅЛЏЗДгІЮЊПЩФцЗДгІЃЌЫљвдЩњГЩЕФввЫсввѕЅИіЪ§аЁгк2NAЃЌCДэЮѓЃЛ
DЃЎ1molЕФЦЯЬбЬЧКЌга5molєЧЛљКЭ1molШЉЛљЃЌ1Llmol/LЕФЦЯЬбЬЧШмвКжаШмжЪЦЯЬбЬЧЕФЮяжЪЕФСПЮЊ5molЃЌЫљКЌєЧЛљЕФИіЪ§ЮЊ5NAЃЌDе§ШЗЁЃ
Д№АИбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФёЗрЪЏ[ЛЏбЇЪНЮЊMg(NH4)PO4ЁЄ6H2O]ЪЧвЛжжЪЂВњгкУиТГЕФгХжЪЕЊСзЗЪСЯЃЛюм(Co)ЪЧжЪзгЪ§ЮЊ27ЕФдЊЫиЃЌЫќЕФжазгЪ§ЮЊ33ЕФКЫЫиПЩгУгкАЉжЂЕФЗХЩфаджЮСЦЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
ЂйюмВЛЪЧжїзхдЊЫиЃЛЂк![]() Cl2ВЛФмГЄЦкЮШЖЈЕиДцдкЃЛЂлMgЕФдзгНсЙЙЪОвтЭМЮЊ
Cl2ВЛФмГЄЦкЮШЖЈЕиДцдкЃЛЂлMgЕФдзгНсЙЙЪОвтЭМЮЊ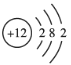 ЃЛЂмФёЗрЪЏжаСНжжбєРызгЮЊMg2+ЁЂNH4+
ЃЛЂмФёЗрЪЏжаСНжжбєРызгЮЊMg2+ЁЂNH4+
A.ЂйЂкЂлЂмB.НіЂйЂкЂмC.НіЂкЂлЂмD.НіЂйЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЃЎШчЭМЮЊдЕчГизАжУЪОвтЭМЁЃ

ЃЈ1ЃЉШєAЮЊPbЃЌBЮЊPbO2ЃЌЕчНтжЪЮЊH2SO4ШмвКЃЌЙЄзїЪБЕФзмЗДгІЮЊPbЃЋPbO2ЃЋ2H2SO4===2PbSO4ЃЋ2H2OЃЌаДГіBЕчМЋЗДгІЪНЃК__________ЁЃИУЕчГидкЙЄзїЪБЃЌAЕчМЋЕФжЪСПНЋ_______(ЬюЁАдіМгЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЃЌШєИУЕчГиЗДгІЯћКФСЫ0.1 mol H2SO4ЃЌдђзЊвЦЕчзгЕФЪ§ФПЮЊ________ЁЃ
ЃЈ2ЃЉШєAЁЂBОљЮЊВЌЦЌЃЌЕчНтжЪЮЊKOHШмвКЃЌЗжБ№ДгAЁЂBСНМЋЭЈШыH2КЭO2ЃЌИУЕчГиМДЮЊЧтбѕШМСЯЕчГиЃЌаДГіAЕчМЋЗДгІЪНЃК_____________________________ЁЃИУЕчГидкЙЄзївЛЖЮЪБМфКѓЃЌШмвКЕФМюадНЋ________(ЬюЁАдіЧПЁБЁАМѕШѕЁБЛђЁАВЛБфЁБ)ЁЃ
ЂђЃЎЯжгУЭМзАжУРДВтЖЈФГдЕчГиЙЄзїЪБдкФГЖЮЪБМфФкЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЁЃСПЭВЕФЙцИёЮЊ1000 mLЃЌЙЉбЁдёЕФЕчМЋВФСЯгаДПЭЦЌКЭДПаПЦЌЁЃ

ЃЈ3ЃЉbЕчМЋВФСЯЮЊ________ЃЌЦфЕчМЋЗДгІЪНЮЊ_________________________ЁЃ
ЃЈ4ЃЉЕБСПЭВжаЪеМЏЕН672 mL(БъзМзДПіЯТ)ЦјЬхЪБЃЌЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЮЊ________molЃЌДЫЪБaЕчМЋжЪСП________(ЬюЁАдіМгЁБЛђЁАМѕЩйЁБ)________gЁЃ
ЃЈ5ЃЉШчЙћНЋaЁЂbСНЕчМЋЕФЕчМЋВФСЯЖдЕїЃЌUаЮЙмжаНЋГіЯжЕФЯжЯѓЪЧ_____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПKIO3ЪЧвЛжжживЊЕФЮоЛњЛЏКЯЮяЃЌПЩзїЮЊЪГбЮжаЕФВЙЕтМСЁЃЛиД№ЯТСаЮЪЬтЃК
(1)KIO3ЕФЛЏбЇУћГЦЪЧ_______ЁЃ
(2)РћгУЁАKClO3бѕЛЏЗЈЁБжЦБИKIO3ЙЄвеСїГЬШчЯТЭМЫљЪОЃК
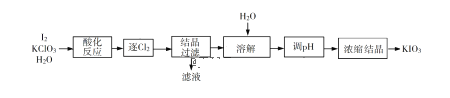
ЁАЫсЛЏЗДгІЁБЫљЕУВњЮягаKH(IO3)2ЁЂCl2КЭKClЁЃЁАж№Cl2ЁБВЩгУЕФЗНЗЈЪЧ________ЁЃЁАТЫвКЁБжаЕФШмжЪжївЊЪЧ_______ЁЃЁАЕїpHЁБжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
(3)KClO3вВПЩВЩгУЁАЕчНтЗЈЁБжЦБИЃЌзАжУШчЭМЫљЪОЁЃ
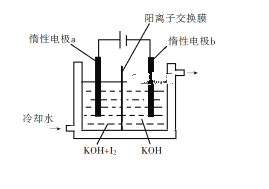
ЂйаДГіЕчНтЪБвѕМЋЕФЕчМЋЗДгІЪН______ЁЃ
ЂкЕчНтЙ§ГЬжаЭЈЙ§бєРызгНЛЛЛФЄЕФРызгжївЊЮЊ_________ЃЌЦфЧЈвЦЗНЯђЪЧ_____________ЁЃ
ЂлгыЁАЕчНтЗЈЁБЯрБШЃЌЁАKClO3бѕЛЏЗЈЁБЕФжївЊВЛзужЎДІга__________(аДГівЛЕу)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаAЁЂBЁЂCЁЂDЁЂEЮхжжЖЬжмЦкжїзхдЊЫиЃЌЦфдзгађЪ§вРДЮдіДѓЃЌдкдЊЫижмЦкБэжаЃЌAЕФдзгАыОЖзюаЁЃЌBЕФзхађЪ§ЪЧЦфЫљдкжмЦкађЪ§ЕФ2БЖЃЌDЪЧЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЌдкдЊЫижмЦкБэжаAКЭEЭЌжїзхЁЃЪдЛиД№ЯТСаЮЪЬтЃК
(1)ЛЏКЯЮя![]() ЕФЕчзгЪНЮЊ______ЁЃ
ЕФЕчзгЪНЮЊ______ЁЃ
(2)ЛЏКЯЮя![]() ЕФЕчзгЪНЮЊ______ЁЃ
ЕФЕчзгЪНЮЊ______ЁЃ
(3)CЕФМђЕЅЧтЛЏЮягыCЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗДгІЩњГЩЕФбЮЕФЛЏбЇЪНЮЊ______ЁЃ
(4)НЋЮяжЪЕФСПжЎБШЮЊ1:1ЕФ![]() КЭ
КЭ![]() зщГЩЕФЛьКЯЦјЬхЭЈШыЕНa molЕФЙ§СПЙЬЬх
зщГЩЕФЛьКЯЦјЬхЭЈШыЕНa molЕФЙ§СПЙЬЬх![]() жаЃЌНЋЗДгІКѓЕФЙЬЬхЛьКЯЮяМгШыЕН500 mL 1 mol/LЕФбЮЫсжаЃЌВњЩњЮоЩЋЛьКЯЦјЬхЕФЬхЛ§ЮЊb L(БъзМзДПіЯТ)ЃЌЗДгІКѓШмвКГЪжаадЃЌдђaЃН______ЃЌbЃН______ЁЃ
жаЃЌНЋЗДгІКѓЕФЙЬЬхЛьКЯЮяМгШыЕН500 mL 1 mol/LЕФбЮЫсжаЃЌВњЩњЮоЩЋЛьКЯЦјЬхЕФЬхЛ§ЮЊb L(БъзМзДПіЯТ)ЃЌЗДгІКѓШмвКГЪжаадЃЌдђaЃН______ЃЌbЃН______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввѕЃЫЎбюЫсЃЈАЂЫОЦЅСжЃЉЪЧФПЧАГЃгУвЉЮяжЎвЛЁЃЪЕбщЪвЭЈЙ§ЫЎбюЫсНјааввѕЃЛЏжЦБИАЂЫОЦЅСжЕФвЛжжЗНЗЈШчЯТЃК

ЫЎбюЫс | ДзЫсєћ | ввѕЃЫЎбюЫс | |
ШлЕу/Ёц | 157~159 | -72~-74 | 135~138 |
ЯрЖдУмЖШ/ЃЈgЁЄcmЉ3ЃЉ | 1.44 | 1.10 | 1.35 |
ЯрЖдЗжзгжЪСП | 138 | 102 | 180 |
ЪЕбщЙ§ГЬЃКдк100 mLзЖаЮЦПжаМгШыЫЎбюЫс6.9 gМАДзЫсєћ10 mLЃЌГфЗжвЁЖЏЪЙЙЬЬхЭъШЋШмНтЁЃЛКТ§ЕЮМг0.5 mLХЈСђЫсКѓМгШШЃЌЮЌГжЦПФкЮТЖШдк70 ЁцзѓгвЃЌГфЗжЗДгІЁЃЩдРфКѓНјааШчЯТВйзї.
ЂйдкВЛЖЯНСАшЯТНЋЗДгІКѓЕФЛьКЯЮяЕЙШы100 mLРфЫЎжаЃЌЮіГіЙЬЬхЃЌЙ§ТЫЁЃ
ЂкЫљЕУНсОЇДжЦЗМгШы50 mLБЅКЭЬМЫсЧтФЦШмвКЃЌШмНтЁЂЙ§ТЫЁЃ
ЂлТЫвКгУХЈбЮЫсЫсЛЏКѓРфШДЁЂЙ§ТЫЕУЙЬЬхЁЃ
ЂмЙЬЬхОДПЛЏЕУАзЩЋЕФввѕЃЫЎбюЫсОЇЬх5.4 gЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉИУКЯГЩЗДгІжагІВЩгУ__________МгШШЁЃЃЈЬюБъКХЃЉ
AЃЎШШЫЎдЁ BЃЎОЦОЋЕЦ CЃЎУКЦјЕЦ DЃЎЕчТЏ
ЃЈ2ЃЉЯТСаВЃСЇвЧЦїжаЃЌЂйжаашЪЙгУЕФга________ЃЈЬюБъКХЃЉЃЌВЛашЪЙгУЕФ_______________________ЃЈЬюУћГЦЃЉЁЃ

ЃЈ3ЃЉЂйжаашЪЙгУРфЫЎЃЌФПЕФЪЧ______________________________________ЁЃ
ЃЈ4ЃЉЂкжаБЅКЭЬМЫсЧтФЦЕФзїгУЪЧ_________________________________ЃЌвдБуЙ§ТЫГ§ШЅФбШмдгжЪЁЃ
ЃЈ5ЃЉЂмВЩгУЕФДПЛЏЗНЗЈЮЊ____________ЁЃ
ЃЈ6ЃЉБОЪЕбщЕФВњТЪЪЧ_________%ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЫЬхбЊвКРяCa2+ЕФХЈЖШвЛАуВЩгУg/cm3РДБэЪОЃЈМД1cm3бЊбљжаКЌгаЕФCa2+ЕФжЪСПЃЉЁЃГщШЁвЛЖЈЬхЛ§ЕФбЊбљЃЌМгЪЪСПЕФВнЫсяЇ[(NH4)2C2O4]ШмвКЃЌПЩЮіГіВнЫсИЦЃЈCaC2O4ЃЉГСЕэЃЌНЋДЫВнЫсИЦГСЕэЯДЕгКѓШмгкЧПЫсПЩЕУШѕЫсВнЫсЃЈH2C2O4ЃЉЃЌдйгУKMnO4ШмвКЕЮЖЈМДПЩВтЖЈбЊвКбљЦЗжаCa2+ЕФХЈЖШЁЃ
ФГбаОПадбЇЯАаЁзщЩшМЦШчЯТЪЕбщВНжшВтЖЈбЊвКбљЦЗжаCa2+ЕФХЈЖШЁЃ
ЃЈВНжш1ЃКХфжЦKMnO4БъзМШмвКЃЉ
ШчЭМЪЧХфжЦ100mLKMnO4БъзМШмвКЕФЙ§ГЬЪОвтЭМЁЃ
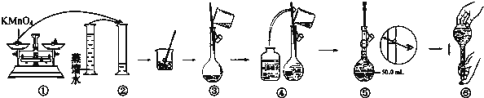
ЃЈ1ЃЉЧыФуЙлВьЭМЪОХаЖЯЃЌЦфжаВЛе§ШЗЕФСНЯюВйзїга___ЃЈЬюађКХЃЉЃЛ
ЃЈ2ЃЉЦфжаШЗЖЈ100mLШмвКЬхЛ§ЕФвЧЦїЪЧ____ЁЃ
ЃЈ3ЃЉШчЙћгУЭМЪОЕФВйзїЫљХфжЦЕФШмвКНјааЪЕбщЃЌдкЦфЫћВйзїе§ШЗЕФЧщПіЯТЃЌЫљХфжЦЕФШмвКХЈЖШНЋ___ЃЈЬюЁАЦЋДѓЁБЛђЁАЦЋаЁЁБЃЉЁЃ
ЃЈВНжш2ЃКВтЖЈбЊвКбљЦЗжаCa2+ЕФХЈЖШЃЉ
ГщШЁбЊбљ20.00mLЃЌОЙ§ЩЯЪіДІРэКѓЕУЕНВнЫсЃЌдйгУ0.020mol/LЫсадKMnO4ШмвКЕЮЖЈЃЌЪЙВнЫсзЊЛЏГЩCO2внГіЃЌетЪБЙВЯћКФ12.00mLKMnO4ШмвКЁЃ
ЃЈ4ЃЉаДГіВнЫсгыЫсадKMnO4ШмвКЗДгІЕФРызгЗНГЬЪН____ЁЃ
ЃЈ5ЃЉЕЮЖЈЕФжеЕуЮЊ____ЁЃ
ЃЈ6ЃЉОЙ§МЦЫуЃЌбЊвКбљЦЗжаCa2+ЕФХЈЖШЮЊ____g/cm3ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАЂБШЖфЖћФмгааЇвжжЦаТаЭЙкзДВЁЖОЃЌЛЏКЯЮя G ЪЧКЯГЩАЂБШЖфЖћЕФжаМфЬхЃЌЦфКЯГЩТЗЯпШчЯТЃК
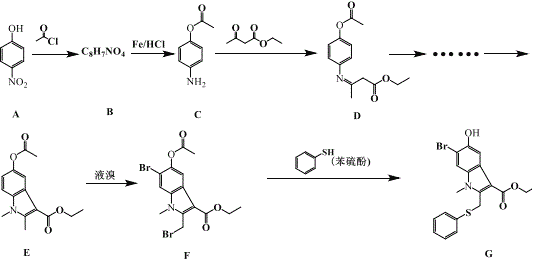
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAЕФЛЏбЇУћГЦЮЊ_____ЃЛB ЕФНсЙЙМђЪНЮЊ_____ЁЃ
ЃЈ2ЃЉгЩ B ЕНC ЕФЗДгІРраЭЗжБ№ЮЊ________________ЁЃ
ЃЈ3ЃЉдкКЯГЩЛЏКЯЮяGЕФСїГЬжаЃЌгЩAЕНBЕФФПЕФЪЧ________________________ЁЃ
ЃЈ4ЃЉБНСђЗгЕФаджЪгыБНЗгЯрЫЦЃЌБНСђЗгЕФЙйФмЭХЮЊ_____ЃЈаДНсЙЙМђЪНЃЉЃЛгУ NaOHБъзМШмвКПЩЕЮЖЈБНСђЗгШмвКЃЌИУЙ§ГЬбЁгУЕФжИЪОМСЮЊ_____ЁЃ
ЃЈ5ЃЉгЩ DЕФНсЙЙПЩХаЖЯЃКD гІДцдкСЂЬхвьЙЙЁЃИУСЂЬхвьЙЙЬхЕФНсЙЙМђЪНЮЊ_____ЁЃ
ЃЈ6ЃЉH ЪЧAЕФЭЌЯЕЮяЃЌЦфЯрЖдЗжзгжЪСПБШA Дѓ 14ЁЃH ЕФЭЌЗжвьЙЙЬхФмЭЌЪБТњзуШчЯТЬѕМўЕФЙВга____жжЃЈВЛПМТЧСЂЬхвьЙЙЃЉЃК
ЂйБНЛЗЩЯга 3 ИіШЁДњЛљЃЌЧвгі FeCl3 ШмвКЯдЩЋ
ЂкМШФмЗЂЩњвјОЕЗДгІгжФмЗЂЩњЫЎНтЗДгІ
аДГіЦфжавЛжжКЫДХЙВеёЧтЦзгаЮхзщЗхЃЌЗхУцЛ§жЎБШЮЊ 1ЃК1ЃК1ЃК2ЃК2 ЕФНсЙЙМђЪН_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщРћгУNaIШмвКжаЭЈШыЩйСПCl2ЕУЕНКЌЕтЗЯвКЃЌдйРћгУКЌЕтЗЯвКЛёШЁNaIЙЬЬхЃЌЪЕбщСїГЬШчЯТЃК

вбжЊЗДгІЂкЃК2IЉ+2Cu2++![]() +H2O
+H2O![]() 2CuIЁ§+
2CuIЁ§+![]() +2H+ЁЃ
+2H+ЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЙ§ТЫЪЕбщЫљашвЊЕФВЃСЇвЧЦїгаЦеЭЈТЉЖЗЁЂЩеБЁЂ_____________ЁЃ
ЃЈ2ЃЉЗДгІЂлжаCuIБЛбѕЛЏЃЌЛЙдВњЮяжЛгаNO2ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________________ЁЃЕБга95.5 g CuIВЮгыЗДгІЃЌдђашвЊБъПіЯТ______________LЕФO2ВХФмНЋЩњГЩЕФNO2дкЫЎжаЭъШЋзЊЛЏЮЊЯѕЫсЁЃ
ЃЈ3ЃЉЛЏКЯЮяBжаКЌСНжждЊЫиЃЌЬњдзггыСэвЛжждЊЫидзгЕФЮяжЪЕФСПжЎБШЮЊ3ЁУ8ЃЌдђЛЏКЯЮяBЕФЛЏбЇЪНЮЊ_____________ЁЃ
ЃЈ4ЃЉЗДгІЂнжаЩњГЩКкЩЋЙЬЬхКЭЮоЩЋЦјЬхЃЌКкЩЋЙЬЬхЕФЫзГЦЮЊДХадбѕЛЏЬњЃЌдђЗДгІЂнЕФЛЏбЇЗНГЬЪНЮЊ______ЁЃ
ЃЈ5ЃЉНЋзуСПЕФCl2ЭЈШыКЌ12 g NaIЕФШмвКжаЃЌвЛЖЮЪБМфКѓАбШмвКеєИЩЕУЕНЙЬЬхЕФжЪСПЮЊ_________gЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com