
【题目】已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是
![]()
A. X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素
B. 物质W可能是化合物,也可能是单质
C. 上述转化关系中不可能出现置换反应
D. 若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体催化剂) 合成 NH3 的原理示意图,化学方程式为 2N2+6H2O=4NH3+3O2。下列说法不正确的是()
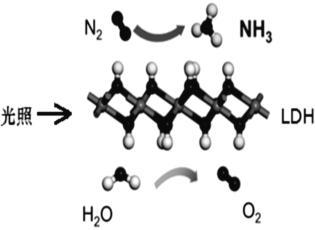
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及共价键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为 4∶3
D. 2molN2 与足量水充分反应,能制得氨气 4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习化学的一种重要思想,下列关于物质的分类组合正确的是( )
分类组合 | 酸 | 碱 | 盐 | 酸性氧化物 | 碱性氧化物 |
A | 盐酸 | Na2CO3 | K2CO3 | CO2 | CaO |
B | 硝酸 | Ca(OH)2 | NaHSO4 | MgO | CO |
C | 硫酸 | 烧碱 | NaHCO3 | P2O5 | Na2O |
D | H2CO3 | Na2CO3 | CaCO3 | SO2 | CuO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
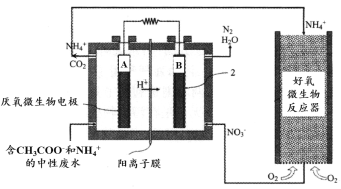
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应常常伴随颜色变化,下列反应产物的颜色按红色、红褐色、黑色、蓝色顺序排列的是( )
①金属铁在纯氧中燃烧冷却后
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间后
③NaOH溶液中滴入酚酞
④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上氨气的催化氧化反应的化学方程式_____________
(2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式_____________;
(3)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g) = CF4(g)+4HF(g)
ΔH =-1940 kJ·mol-1,计算H—F键的键能为______________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(4)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和一种还原性的气体,放出热量4.28kJ,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,B、 D是中学化学常见金属,D在生活中应用最广泛。

(1)写出物质A与盐酸反应的离子方程式_____。
(2)探究A和B反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解, (假设固体全部溶解后溶液体积不变),反应过程中无气体放出 (活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如图所示:
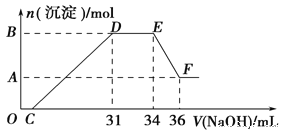
①写出DE段发生反应的离子方程式:_____。
②B与A的差值为_____mol。
③求c(HNO3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_______(用离子符号表达)。
(2)W的最简单氢化物的电子式为______。
(3)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为:________。Y的最高价氧化物与Z的气态氢化物的水溶液反应的离子方程式:__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com