
【题目】下列有关二氧化硫的说法正确的是
A.易溶于水
B.密度比空气小
C.无色无味
D.能将品红溶液氧化褪色
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图,下列说法正确的是

A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式一定是:2Fe + O2 + 2H2O === 2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时;
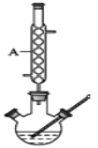
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是___________,制备水杨酸甲酯时,最合适的加热方法是__________。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是_____________________。
(3)反应结束后,分离甲醇的操作是_____________。
(4)洗涤操作中,第一次水洗的主要目的是__________,第二次水洗的主要目的是________。
(5)检验产品中是否含有水杨酸的化学方法是________________________。
(6)本实验的产率为___________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式____________________________________________。
(2)写出草酸(H2C2O4)使酸性高锰酸钾褪色的离子方程式__________________________ 。
(3)写出向Na2S2O3 中加入稀硫酸反应的离子方程式______________________________ 。
(4)已知:Se + 2H2SO4(浓) =2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O =Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(5)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。_________________________。
(6)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
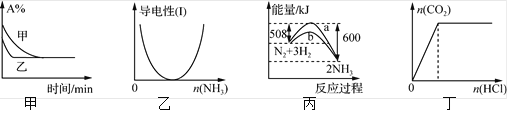
A. 图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A. A的转化率增大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为1 L的恒容密闭容器中充入2molPCl3和2molCl2,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达到平衡时,PCl5的物质的量为1mol,若此时移走1mol PCl5,则在相同温度下再达到平衡时,PCl5的物质的量约为
PCl5(g)。达到平衡时,PCl5的物质的量为1mol,若此时移走1mol PCl5,则在相同温度下再达到平衡时,PCl5的物质的量约为
A. 0.38mol B. 0.50mol C. 0.63mol D. 0.71mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。


下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的![]() 倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com