
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
阴离子 | SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______(填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______。
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______(填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为__________________。
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
(1)Ba(OH)2 a<b
(2)Al2O3
(3)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(4)正向 c(Na+)= c(SO42-)>c(NH4+)>c(H+)>c(OH-)
(5)100x mol/L
【解析】根据①有刺激性气味的气体为氨气,可知A或B中含有铵离子;结合②和③,A与C生成了沉淀乙,A还能够与沉淀乙继续反应,生成的沉淀乙被A溶解,证明沉淀乙为氢氧化铝,A中含有氢氧根离子,所以B中含有铵离子,能够与氢氧根离子结合,反应后生成沉淀的只有钡离子,所以A为氢氧化钡;B能够溶解氢氧化铝沉淀,B中一定含有氢离子,且能够完全电离出氢离子,所以B为硫酸氢铵;根据③可知C中含有铝离子,则C为氯化铝,最后剩下的D为碳酸钠,所以A为氢氧化钡、B为硫酸氢铵、C为氯化铝、D为碳酸钠,
(1)A为氢氧化钡,其化学式为:Ba(OH)2;碳酸钠溶液中碳酸根离子存在电离平衡,稀释后碳酸根离子水解程度增大,溶液中氢氧根离子物质的量增加,氢氧化钡溶液和碳酸钠溶液的pH相等,稀释后氢氧化钡溶液中氢氧根离子物质的量基本不变,所以稀释后氢氧化钡溶液中氢氧根离子浓度小于碳酸钠溶液中氢氧根离子浓度,溶液的pH:a<b。
(2)加热蒸干氯化铝溶液并灼烧,由于铝离子水解生成氢氧化铝和氯化氢,氯化氢具有挥发性,蒸干后得到了氢氧化铝,灼烧后达到了氧化铝。
(3)氯化铝溶液中铝离子与碳酸钠溶液中的碳酸根离子发生双水解,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(4)NH4HSO4是酸式盐,溶液显酸性,滴加NaOH溶液促进了NH4+的水解,因此水的电离平衡正向移动。加入等量的NaOH溶液,所得溶液为等物质的量的Na2SO4、(NH4)2SO4的混合溶液,NH4+水解,使溶液显酸性,因此各离子浓度由大到小的顺序为c(Na+)= c(SO42-)> c(NH4+)> c(H+)> c(OH-)。
(5)BaSO4的Ksp=c(Ba2+)·c(SO42-),0.03mol·L-1的Ba(OH)2溶液与0.01mol·L-1的NH4HSO4溶液等体积混合,设溶液体积为1L,则反应生成BaSO40.01mol,剩余Ba2+的物质的量为0.02mol,溶液中Ba2+的浓度为0.01mol·L-1,则c(SO42-)=Ksp/c(Ba2+)=x/0.01mol/L=100 x mol/L


科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1 mol CuFeS2完全反应转移13 mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
下列各组离子可能大量共存的是
A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、S2-、Br-
B.遇pH试纸变红色的溶液:Fe2+、S2O、SO42-、Na+
C.水电离出的c(H+) ?c(OH-) =10-28的溶液:Na+、S2-、NO3- 、SO32 -
D.能使KSCN显红色的溶液:Na+、NH4+、AlO、CO
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
下列实验步骤与实验事实的相应结论解释正确的是
选项 | 实验步骤与实验事实 | 结论解释 |
A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
【有机物化学基础】
A-G均为有机化合物,其中A为二卤代烃,相对分子质量为216,碳的质量分数为22.2%。相关转化关系如下:
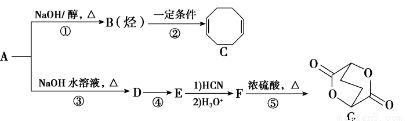
已知: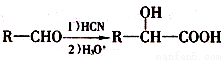
请回答:
(1)C的核磁共振氢谱有_______个吸收峰。
(2)①、④的反应类型分别为________、______。
(3)下列关于F的说法正确的是_______ (填选项字母)。
a.1 mol F与足量金属钠反应最多生成2 mol H2
b.1 mol F完全燃烧消耗8.5 mol O2
c.能与新制Cu(OH)2反应生成砖红色沉淀
d.能与NaHCO3反应生成CO2
(4)写出下列反应的化学方程式
反应③___________________________________;
反应⑤___________________________________;
(5)符合下列条件的同分异构体有_____种,任写其中一种的结构简式_____。
i.与E互为同系物 ii.相对分子质量比E大28
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列说法一定正确的是(NA表示阿伏加德罗常数)
A.常温下4.4gN2O与标准状况下2.24LCH4均含有0.1NA个分子
B.78g金属钾(K)完全转化为超氧化钾(KO2)时,转移电子数为4NA
C.0.1mol/L稀盐酸中,H+数目为0.1NA
D.60g二氧化硅晶体中,含S—O键数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
右图为元素周期表短周期的一部分,E原子的电子层数为n,最外层电子数为2n+1下列述不正确的是
A |
| B | C |
|
| D | E |
A.C和E氢化物的热稳定性和还原性均依次减弱
B.A与B形成的阴离子可能有AB32- A2B42-
C.AD2分子中每个原子的最外层均为8电子结构
D.A、D、E的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合5 题型:简答题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
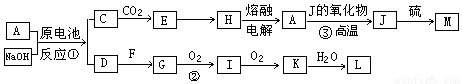
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com