
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1 mol CuFeS2完全反应转移13 mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降
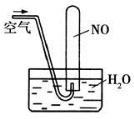
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列说法正确的是( )
A、煤的液化和气化都是物理变化
B、乙醇、乙酸和甲醛广泛应用于食品加工
C、蛋白质、橡胶和塑料都是天然高分子
D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:实验题
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
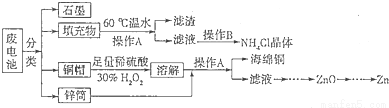
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)操作A的名称为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式 。
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_______方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
磷酸吡醛素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图。下列说法错误的是
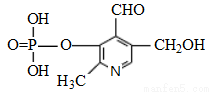
A、该酯分子式为C8H9O6NP
B、该酯能使石蕊试液变红
C、该酯能与金属钠反应
D、该酯能与乙醇发生酯化反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:

A.步骤Ⅰ中减少的3 g固体一定是混合物
B.步骤Ⅱ中质量减少的物质一定是Cu
C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:填空题
【物质结构与性质】
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:
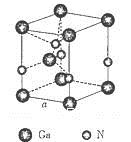
①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
阴离子 | SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______(填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______。
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______(填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为__________________。
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
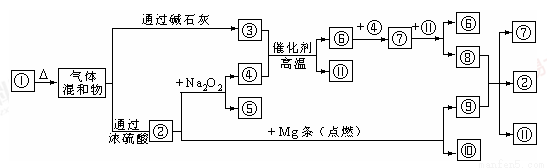
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com