
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
分析 (1)添加试剂的顺序是先加入密度小的,再加入密度大的,注意浓硫酸溶于水放热和加热时试管内液体的体积不超过试管容积的$\frac{1}{3}$;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)乙醇、乙酸的沸点较低,易挥发,温度高原料损失,及发生副反应;
(4)乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解,无水硫酸钠吸水形成硫酸钠结晶水合物;
(5)依据浓硫酸性质和实验室制取乙酸乙酯的反应特征分析其在反应中的作用;
(6)根据导管伸入液面下可能发生倒吸分析.
(7)分离互不相溶的液体,可用分液的方法分离;
(8)乙酸随乙酸乙酯挥发出来,乙酸与碳酸氢钠反应.
解答 解:(1)乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的$\frac{1}{3}$,加入药品的顺序为:在大试管中(30mL的大试管)先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4mL乙酸并摇匀,
故答案为:在大试管中先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4 mL乙酸并摇匀;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以BC正确,
故答案为:BC;
(3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,
故答案为:防止反应物随生成物一起大量被蒸出来,导致原料损失,及发生副反应;
(4)无水硫酸钠吸水形成硫酸钠结晶水合物,可干燥乙酸乙酯,不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解,
故答案为:B;
(5)实验室制取乙酸乙酯的化学方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,该反应为可逆反应,浓硫酸具有吸水性,在酯化反应中促进反应平衡向右移动,所以浓硫酸的作用为:催化剂和吸水剂的作用,
CH3COOC2H5+H2O,该反应为可逆反应,浓硫酸具有吸水性,在酯化反应中促进反应平衡向右移动,所以浓硫酸的作用为:催化剂和吸水剂的作用,
故答案为:催化作用;吸水作用;
(6)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(7)分离乙酸乙酯时先用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,然后进行分液操作,静置分层后取上层得乙酸乙酯,
故答案为:用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液;
(8)乙酸酸性比碳酸强,乙酸与碳酸氢钠反应,反应方程式为CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.说明乙酸乙酯中含有乙酸,
故答案为:乙酸乙酯中含有乙酸;CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H3PO4 | B. | Na3PO4 | C. | Ag | D. | Na2HPO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡 | |
| B. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| C. | 为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为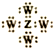 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |
查看答案和解析>>
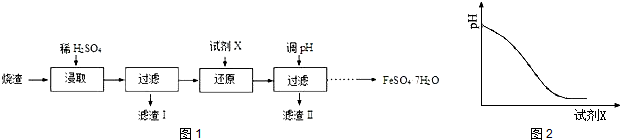
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
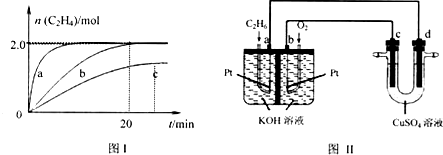
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com