
分析 加热发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,若碳酸氢钠过量,还发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,若NaOH、NaHCO3恰好按1:1反应,固体减少质量为水的质量,根据方程式可知,生成水的质量=33.2g×$\frac{18}{124}$=4.8g,实际固体质量减少=33.2g-26.5g=6.7g>4.8g,所以碳酸氢钠过量,根据方程式计算NaHCO3的质量,进而计算NaOH的质量,再计算氢氧化钠的质量分数.
解答 解:设氢氧化钠和碳酸氢钠的物质的量分别为xmol和ymol,
NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,
xmol xmol xmol
若碳酸氢钠过量,还发生反应:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
y-x $\frac{1}{2}$(y-x)
则:$\left\{\begin{array}{l}{40x+84y=33.2g}\\{\frac{1}{2}(y-x)+x=\frac{26.5g}{106g/mol}}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.2mol}\\{y=0.3mol}\end{array}\right.$,所以混合物中NaOH与NaHCO3的物质的量之比为2:3,
NaOH的质量分数为$\frac{0.2×40}{33.2}×100%$=24.1%,故答案为:2:3;24.1%.
点评 本题考查混合物的有关计算,判断容器内发生的反应是关键,可以根据二者按物质的量之比1:1反应计算固体质量减少判断发生的反应,难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合前醋酸溶液中水的电离程度大 | |
| B. | 混合前c(CH3COOH)大于c(Na+) | |
| C. | 混合后若c(Na+)=c(CH3COO-),则混合前乙酸体积大 | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗B 0.08mol | B. | x=2 | ||
| C. | A的平衡浓度是1.4mol/L | D. | 平衡时气体压强是原来的0.94倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
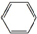 .
. ,取代反应.
,取代反应.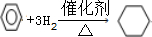 ,加成反应.
,加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA | |
| B. | 高温下,0.2molFe与足量水蒸气反应,转移电子数目为0.6NA | |
| C. | 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
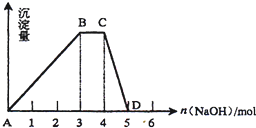
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
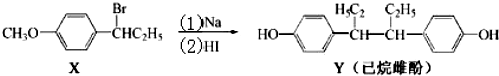
| A. | 化合物X 的分子式为C9H13BrO | B. | 化合物X苯环上的一溴代物有四种 | ||
| C. | 用FeCl3溶液可鉴别化合物X和Y | D. | 反应(2)属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com