
| A. | 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA | |
| B. | 高温下,0.2molFe与足量水蒸气反应,转移电子数目为0.6NA | |
| C. | 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.5NA |
分析 A.氧气和臭氧均由氧原子构成;
B.铁与水蒸气反应时,3mol铁生成4mol氢气,转移8mol电子;
C.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子,消耗0.2mol过氧化钠;
D.从元素的化合价的变化角度分析氧化剂和还原剂,根据氧化还原反应得失电子数目相等计算转移电子的物质的量.
解答 解:A.氧气和臭氧均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,故含0.2NA个原子,故A正确;
B.铁与水蒸气反应时,3mol铁生成4mol氢气,故0.2mol铁生成0.26mol氢气即0.26NA个氢气分子,转移电子数0.52NA个,故B错误;
C.过氧化钠与水反应时,氧元素由-1价变为0价,故消耗0.1mol过氧化钠,生成0.05mol氧气,转移电子的数目为0.1NA,故C正确;
D.KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,Cl元素化合价降低,则KClO3被还原,为氧化剂,HCl为还原产物,标准状况下6.72LCl2的物质的量为$\frac{6.72L}{2.24L/mol}$=0.3mol,转移的电子数为0.1mol×5=0.5mol,转移电子数目为0.5NA,故D正确;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意氧化还原反应转移电子依据化合价变化计算的方法,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | HNO3 | B. | HCl | C. | HBr | D. | HF |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
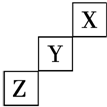
| A. | Z可能是活泼金属元素 | |
| B. | X的最高价氧化物对应的水化物是一种强酸 | |
| C. | Y元素原子的最外层电子数为7 | |
| D. | Z的最高价氧化物对应水化物的化学式为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | SiO32-、OH-、SO32-、Na+ | D. | MnO4-、Cl-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
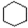 $→_{①}^{Cl_{2}光照}$
$→_{①}^{Cl_{2}光照}$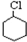 $→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$
$→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$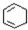 $\stackrel{⑤}{→}$
$\stackrel{⑤}{→}$ $\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
$\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
 ,C
,C .
.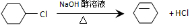 反应⑤
反应⑤ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为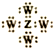 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造制作光导纤维 | |
| B. | 次氯酸钠具有强氧化性,可用于配制“84”消毒液 | |
| C. | 小苏打可用于治疗胃酸过多 | |
| D. | 过氧化钠可用于潜水艇的氧气来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com