
【题目】关于化学键的叙述中,正确的是
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.离子化合物中一定含有金属离子
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H =+41.3kJ·mol-1
CO(g)+H2O(g) △H =+41.3kJ·mol-1
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
①CO2加氢合成乙烯的热化学方程式为_____________________________。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是______(填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①能判断该反应达到化学平衡状态的是_______(填字母)。
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H______0(填“>”或“<”),图中压强p1____p2(填“>”或“<”)。
③经测定知Q点时容器的压强是反应前压强的9/10,则Q点H2的转化率为____________。
④N点时,该反应的平衡常数K=______(计算结果保留两位小数)。
(3)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)烷烃A在同温同压下蒸气的密度是氢气的36倍,A的分子式:_______。
(2)烷烃B的分子中含有200个氢原子,烷烃B的分子式:________。
(3)请用化学方程式表示氯碱工业的反应原理:________。
(4)请用化学方程式表示铝热法炼铁的反应原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g)![]() 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g)![]() 6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)![]() 2H2O(g) ΔH3=b kJ·mol-1
2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3![]() 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________。

(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线如下
,用石油裂解气合成M的路线如下
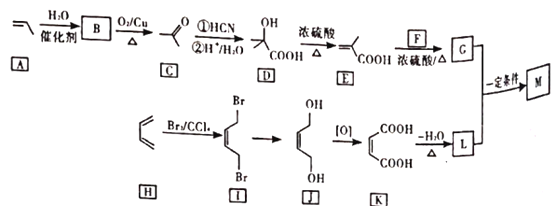
回答下列问题:
(1)B的化学名称为___________。
(2)F的分子式为___________。
(3)G中官能团的名称是___________,G与L在一定条件下生成M的反应类型是___________。
(4)I→J的反应方程式为___________。
(5)写出C的同分异构体的结构简式(核磁共振氢谱为三组峰,峰面积比为3︰2︰1)______。
(6)设计由苯乙烯为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
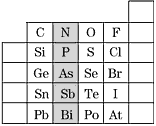
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况)。问:
(1)原溶液中有__________mol Na2CO3,__________mol NaHCO3。
(2)盐酸的物质的量浓度_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com