
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,应采用的措施是 。
(3)用下图装置制备CrCl3时,主要步骤包括:

①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定:
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O![]() 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为_____________________.
【答案】(1)除去其中可溶性杂质;最后一次洗涤的流出液呈无色。
(2)水浴加热(并用温度计指示温度)
(3)②④⑤①
(4)COCl2+2C2H5OH→C2H5OCOC2H5+2HCl
(5)①淀粉②除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差。③96.1%。
【解析】
试题分析:(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质,用蒸馏水洗涤除去其中可溶性杂质;因为(NH4)2Cr2O7显桔红色,最后一次洗涤的流出液呈无色,说明洗涤干净。
(2)因为CCl4沸点为57.6℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度。
(3)分析题意知制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,故操作顺序为:⑥→③→②→④→⑤→①。
(4)由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl,反应方程式为COCl2+2C2H5OH→C2H5OCOC2H5+2HCl。
(5)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,可以用淀粉作指示剂,I2反应完毕蓝色褪去。②溶液中有溶解的氧气,氧气可以氧化I-,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差。③令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3+~Cr2O72-~3I2~6Na2S2O3,根据关系式计算。
2Cr3+~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+) 0.0250mol/L×0.024L
故n(Cr3+)=0.0250mol/L×0.024L×1/3所以250mL溶液中n′(Cr3+)= 0.0250 mol/L × 0.024L × 1/3 × 10=0.002mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.002mol,所以样品中m(CrCl3)=0.002mol×158.5g/mol=0.317g,故样品中无水三氯化铬的质量分数为0.317g/0.33g×100%=96.1%。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: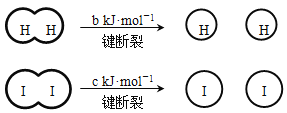 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C.断开2 mol H-I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合在空气中充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
① FeOCr2O3 + Na2CO3 + □ = Na2CrO4 + Fe2O3 + CO2↑
② Na2CO3+Al2O3=2NaAlO2+CO2↑
(2)固体A中主要含有 (填写化学式)。
(3)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
获得K2Cr2O7晶体的操作由多步组成,依次是:加入KCl固体、 、过滤、洗涤、干燥得到晶体。洗涤沉淀的操作为 。
(4)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量 (填写试剂名称)、溶解、过滤、再通入过量的CO2、灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
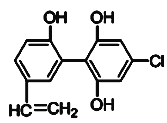
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Cr)工业废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀。转化过程中,废水pH与Cr2O72-转化为Cr3+的关系如图1所示,实验室模拟工业电解法处理含铬废水的装置如图2所示。

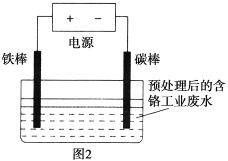
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是__________________。
(2)写出下列反应的离子方程式:
①电解过程中的阴极反应式___________________________;
②Cr2O72-转化为Cr3+的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
(4)实验室中对E装置中的混和物按下图操作:
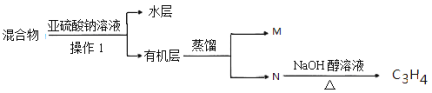
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com