
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
(4)实验室中对E装置中的混和物按下图操作:
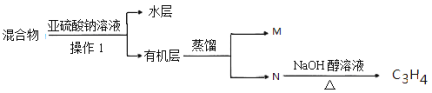
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
【答案】(1)②③①;
(2)控制气体流速;
(3)C2H6+ 7CuO![]() 2CO2 + 3H2O + 7Cu
2CO2 + 3H2O + 7Cu
(4)①分液漏斗、烧杯;C2H4Br2;②SO32- +Br2+ H2O = SO42- + 2Br- + 2H+
(5)0.3 mol
【解析】
试题分析:(1)应先检查整套装置的气密性,排出装置中的空气,再给D、G装置加热,所以正确的操作顺序为:②③①,故答案为:②③①;
(2)B装置中盛有水,可以通过观察B中产生的气泡快慢来控制气体的流速,故答案为:通过观察气泡,调节K,控制气体流速;
(3)加热条件下,C2H6和CuO发生氧化还原反应生成二氧化碳、Cu和水,反应的方程式为C2H6+7CuO![]() 2CO2+3H2O+7Cu,故答案为:C2H6+7CuO
2CO2+3H2O+7Cu,故答案为:C2H6+7CuO![]() 2CO2+3H2O+7Cu;
2CO2+3H2O+7Cu;
(4)混合物中含有单质溴、水、1,2-二溴乙烷、1,2-二溴丙烷,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去单质溴,1,2-二溴乙烷、1,2-二溴丙烷都不溶于水,溶液分层,采用分液的方法分离出混合物和有机层,互溶的1,2-二溴乙烷、1,2-二溴丙烷采用蒸馏的方法分离,根据N在氢氧化钠醇溶液中发生消去反应生成C3H4,可知N为1,2-二溴丙烷,所以M为1,2-二溴乙烷,
①根据上面的分析可知,操作I为分液,用到玻璃仪器是分液漏斗、烧杯,M为1,2-二溴乙烷,其分子式为C2H4Br2,故答案为:分液漏斗、烧杯;C2H4Br2;
②亚硫酸钠溶液的作用是除去溴单质,反应的离子方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+,故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
(5)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,设C2H4的物质的量为x,C3H6的物质的量为y,乙烷和甲烷的物质的量分别是x、y,则:28x+42y=15.4g,G减少的质量是氧化铜中的氧元素质量,乙烷和甲烷和氧化铜反应需要的氧原子的物质的量为:2(2x+y)+![]() =
=![]() ,解得:x=0.1mol、y=0.3mol,所以n(CH4)=n(C3H6)=0.3mol,故答案为:0.3 mol。
,解得:x=0.1mol、y=0.3mol,所以n(CH4)=n(C3H6)=0.3mol,故答案为:0.3 mol。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,应采用的措施是 。
(3)用下图装置制备CrCl3时,主要步骤包括:

①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定:
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O![]() 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留清白在人间
D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____ ___。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_____ __。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。
(4)丙组同学取10 mL0.1mol/L KI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____________(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有 ___(填离子符号),由此可以证明该氧化还原反应为___ ___。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______ _;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__ ____;生成沉淀的原因是____ __(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为
A.4.4g B.2.2g C.1.4g D.在2.2g与4. 4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。很多食品中放有干燥剂,就是利用其具有吸收水分的功能,生石灰就是一种。请写出生石灰吸收水分的化学方程式 ,该反应属于 反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置除去含有CN﹣、Cl﹣ 废水中的CN﹣时,控制溶液pH为9~10,阳极产生的ClO﹣将CN﹣氧化为两种无污染的气体,下列说法不正确的是( )
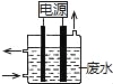
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:Cl﹣+2OH﹣﹣2e﹣═ClO﹣+H2O
C.阴极的电极反应式:2H2O+2e﹣═H2↑+2OH﹣
D.除去CN﹣的反应:2CN﹣+5ClO﹣+2H+═N2↑+2CO2↑+5Cl﹣+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com