
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
科目:高中化学 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.4.6g
B.4.2g
C.4.0g
D.3.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:

用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用 的方法除去;
若产物中有少量未反应的Br2,最好用 洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)下列关于装置的说法正确的是 ;
a.A的滴液漏斗的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫 ,该仪器中盛有的试剂为 .
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值 7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为 .
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? .
(5)装置E的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是
A. 0.1 mol/L的盐酸15mL B. 0.15 mol/L的硫酸溶液8mL
C. 0.4 mol/L的硝酸12mL D. 18 mol/L的浓硫酸15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
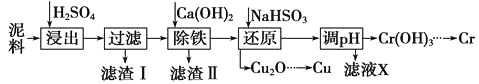
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
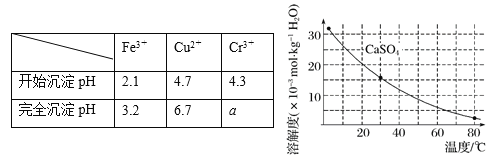
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: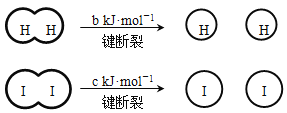 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C.断开2 mol H-I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
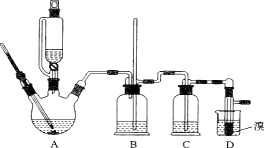
(4)实验室中对E装置中的混和物按下图操作:
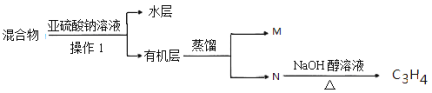
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com