
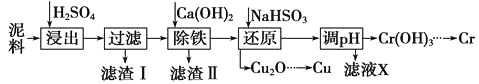
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
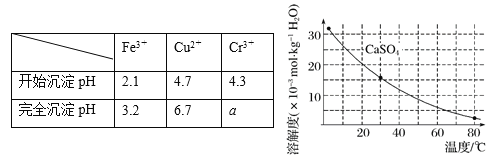
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31,![]() ≈4.0]。
≈4.0]。
【答案】(1)CuSO4
(2)①3.2~4.3取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除②趁热过滤
(3)2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+产生SO2,污染环境
(4)4.0×10-9mol·L-1
【解析】试题分析:(1)Fe2O3、CuO、Cr2O3均能溶于硫酸,分别生成盐[Fe2(SO4)3、CuSO4、Cr2(SO4)3]和水;(2)由部分物质沉淀的pH及除铁操作的目的可知,加入石灰乳调节溶液的pH为3.2~4.3,不会沉淀Cu2+、Cr3+,但能除去Fe3+和CaSO4;Fe3+遇KSCN变红,如果溶液中Fe3+已经除尽,则滤液遇KSCN溶液不变红;再由CaSO4的溶解度曲线可知,CaSO4的溶解度随温度升高而逐渐减小,如果将浊液加热到80℃,趁热过滤,可以除去CaSO4;(3)由铜元素降价可知硫元素必须升价,根据易溶且完全电离的化合物拆写原则、电子电荷原子守恒可知,还原步骤的原理为![]() ;亚硫酸属于中强酸,而还原步骤可以生成的硫酸是强酸,若NaHSO3过量,过量的NaHSO3可以与强酸反应生成有毒的SO2气体,造成环境污染;(4)由沉淀溶解原理可知,Cr(OH)3(s)
;亚硫酸属于中强酸,而还原步骤可以生成的硫酸是强酸,若NaHSO3过量,过量的NaHSO3可以与强酸反应生成有毒的SO2气体,造成环境污染;(4)由沉淀溶解原理可知,Cr(OH)3(s)![]() Cr3++ 3OH-,Ksp[Cr(OH)3] = c(Cr3+)c3(OH-) = 6.3×10-31,则c3(OH-) = 6.3×10-31/1×10-5= 6.3×10-26= 63×10-27,c(OH-) =
Cr3++ 3OH-,Ksp[Cr(OH)3] = c(Cr3+)c3(OH-) = 6.3×10-31,则c3(OH-) = 6.3×10-31/1×10-5= 6.3×10-26= 63×10-27,c(OH-) =![]() mol·L-1= 4.0×10-9 mol·L-1,即要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol·L-1。
mol·L-1= 4.0×10-9 mol·L-1,即要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol·L-1。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞内元素和化合物的叙述,正确的是
A. 组成细胞的主要元素中含量最多的是碳
B. 精瘦肉细胞中含量最多的化合物是蛋白质
C. 在人的一生中,细胞中的自由水/结合水的比值逐渐上升
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2 含有氧原子数为NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl- 数为NA
C.标准状况下,22.4 L H2O的分子数为NA
D.常温常压下,14 g N2含有分子数位0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为 0.672 mL
C.和砒霜反应的锌为3.90 mg
D.生成砷化氢时,转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为
A.4.4g B.2.2g C.1.4g D.在2.2g与4. 4g之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com