
【题目】下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
【答案】CBADE
【解析】
试题分析:A.标准状况下33.6LH2的物质的量为n=![]() =
=![]() =1.5mol;B.每个氢气分子含有2个电子,故含有电子的物质的量为4mol的H2的物质的量为
=1.5mol;B.每个氢气分子含有2个电子,故含有电子的物质的量为4mol的H2的物质的量为![]() =2mol;C.20℃,45gH2O的物质的量为n=
=2mol;C.20℃,45gH2O的物质的量为n=![]() =2.5mol;D.16gO2的物质的量为
=2.5mol;D.16gO2的物质的量为![]() =0.5mol,14gN2的物质的量为
=0.5mol,14gN2的物质的量为![]() =0.5mol,混合气体总的物质的量为1mol;E.原子总数约为1.204×1024的NH3,原子的物质的量为
=0.5mol,混合气体总的物质的量为1mol;E.原子总数约为1.204×1024的NH3,原子的物质的量为![]() =2mol,每个氨气分子含有4个原子,故氨气的物质的量为
=2mol,每个氨气分子含有4个原子,故氨气的物质的量为![]() =0.5mol,根据N=nNA可知,物质的量越大含有分子数目越多,故分子数目由多到少的顺序为CBADE,故答案为:CBADE。
=0.5mol,根据N=nNA可知,物质的量越大含有分子数目越多,故分子数目由多到少的顺序为CBADE,故答案为:CBADE。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:

用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
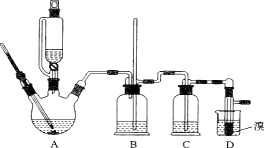
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用 的方法除去;
若产物中有少量未反应的Br2,最好用 洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)下列关于装置的说法正确的是 ;
a.A的滴液漏斗的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
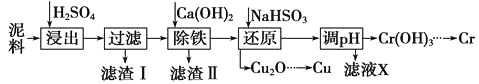
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
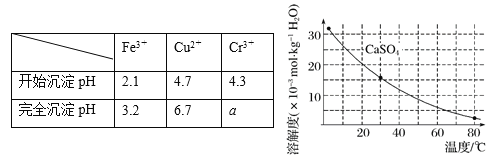
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: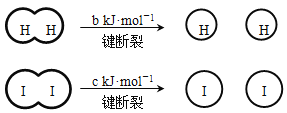 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C.断开2 mol H-I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:

回答下列问题:
(1)滤渣的成分为____________,操作①的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为__________________。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是___________。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要_________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。

①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_________________→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是______。
②点燃B处酒精灯之前必须进行的操作是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合在空气中充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
① FeOCr2O3 + Na2CO3 + □ = Na2CrO4 + Fe2O3 + CO2↑
② Na2CO3+Al2O3=2NaAlO2+CO2↑
(2)固体A中主要含有 (填写化学式)。
(3)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
获得K2Cr2O7晶体的操作由多步组成,依次是:加入KCl固体、 、过滤、洗涤、干燥得到晶体。洗涤沉淀的操作为 。
(4)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量 (填写试剂名称)、溶解、过滤、再通入过量的CO2、灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
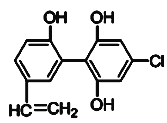
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
(4)实验室中对E装置中的混和物按下图操作:
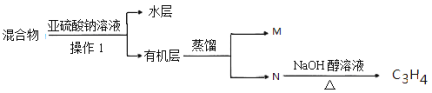
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按单质、氧化物、混合物的顺序排列的是( )
A.冰、干冰、赤铁矿 B.氢气、生石灰、煤
C.红磷、纯碱、石油 D.金刚石、熟石灰、空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com