
【题目】A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质。它们之间的转化关系如下图所示:

请回答下列问题:
(1)B与甲反应的化学方程式是__________________________,该反应中如得到1molA则反应中转移的电子为_________ mol。
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?___________(填“是”或“否”)。
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是______________________。
(4)写出A与水蒸气反应生成C和甲的化学方程式____________________。
(5)将A、B两种金属按一定的质量比组成混合物。取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是______________,混合物中B的物质的量为______________mol(用含字母的分数式表示)。、
【答案】![]()
![]() 否 取少量溶液于试管中,向试管中加入适量KSCN溶液,若溶液呈血红色,则证明溶液中含有Fe3+
否 取少量溶液于试管中,向试管中加入适量KSCN溶液,若溶液呈血红色,则证明溶液中含有Fe3+ ![]()
![]()
![]()
【解析】
A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质,结合转化关系可知,甲为四氧化三铁,B为Al,A为Fe,C为氢气,乙为偏铝酸钠,丙为氯化铁,然后结合元素化合物知识及化学用语来解答。
(1)Al与Fe3O4反应的方程式为:![]() ,Al元素化合价从0升高至+3价,每生成4molAl2O3,转移24mol电子,因此每生成1molFe,转移
,Al元素化合价从0升高至+3价,每生成4molAl2O3,转移24mol电子,因此每生成1molFe,转移![]() mol电子,
mol电子,
故答案为:![]() ;
;![]() ;
;
(2)常温下,Al、Fe与浓硫酸、浓硝酸反应会生成致密的氧化膜,而形成“钝化”,阻止反应的进一步进行,固体不能完全溶解,
故答案为:否;
(3)检验氯化铁溶液中Fe3+的常见方法:取少量溶液于试管中,向试管中加入适量KSCN溶液,若溶液呈血红色,则证明溶液中含有Fe3+,
故答案为:取少量溶液于试管中,向试管中加入适量KSCN溶液,若溶液呈血红色,则证明溶液中含有Fe3+;
(4)Fe与水蒸气反应生成Fe3O4和H2,其化学方程式为:![]() ,
,
故答案为:![]() ;
;
(5)Al与NaOH溶液反应的离子方程式为:![]() ,生成气体的体积在标准状况下体积为nL,n(H2)=
,生成气体的体积在标准状况下体积为nL,n(H2)=![]() mol,则n(Al)=
mol,则n(Al)=![]() mol×
mol×![]() =
=![]() mol,
mol,
故答案为:![]() ;
;![]() 。
。


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
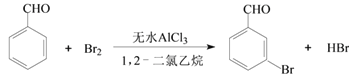
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
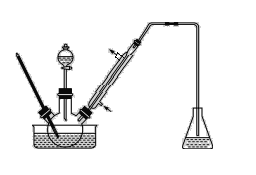
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.除去Cl2中少量的HC1,可将混合气体通过盛有饱和NaCl溶液的洗气瓶
B.向久置于空气的FeCl2溶液中滴入KSCN溶液,会产生Fe(SCN)3血红色物质
C.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液一定含有CO32-
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)乙中含有的官能团的名称为:氯原子和______________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是_________(选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.氢氧化钠溶液
(4)请设计实验证明乙中含有氯元素。
操作 | 现象 | 结论 |
______________ | ___________ | 乙中含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
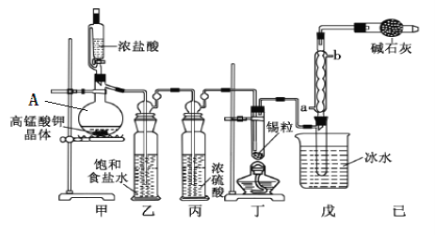
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,MnO4- 被还原为Mn2+,该反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②_______________________________。
(4)如果缺少乙装置,可能发生的副反应的化学方程式为___________________;己装置的作用是_________________:
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
A. H2O2溶液 B. FeCl3溶液(滴有KSCN) C. AgNO3溶液 D. 溴水
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38gSnCl4,则SnCl4的产率为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,其原子半径依X、Z、Y、W的顺序增大。已知Y的气态氢化物水溶液显碱性、Z是地壳中含量最高的元素,W的原子半径在同周期中最小(稀有气体除外)。下列说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,所以W的非金属性比Y强
,所以W的非金属性比Y强
B.X、Y分别与Z按原子个数比2∶1形成的化合物都是弱电解质
C.由Y和Z元素形成的氧化物最多可有5种
D.由X、Y、Z元素组成的化合物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】禁止运动员使用兴奋剂是2012绿色奥运的重要举措之一,下图是兴奋剂利尿酸的结构

关于它的说法正确的是
A.利尿酸的化学式为:C13H14O4Cl2
B.利尿酸最多可与4 molH2发生反应
C.利尿酸可使溴的四氯化碳溶液褪色
D.利尿酸在一定条件下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和苯是有机合成的基础原料,图中是有机物H( )的合成路线(部分产物和条件已省略):
)的合成路线(部分产物和条件已省略):
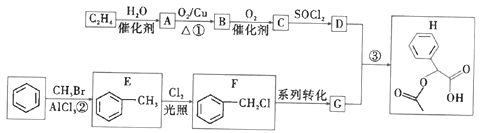
已知:![]() 。
。
请回答下列问题:
(1)B的官能团名称为__________________,反应①②的反应类型分别为_________、_____________。E的名称为_______________。
(2)写出反应③的化学方程式:________________。
(3)P与乙烯的最简式相同,其相对分子质量为56,P的所有可能的结构(含P)数目为__________种(不考虑立体异构),写出P的属于环烃的同分异构体的结构简式:____________________。
(4)![]() 是苯的同系物,M的核磁共振氢谱有2组峰,且峰面积比为2∶3,M的二氯代物有________种。
是苯的同系物,M的核磁共振氢谱有2组峰,且峰面积比为2∶3,M的二氯代物有________种。
(5)已知: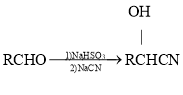 。参照上述流程,设计以F为原料制备G的合成路线:
。参照上述流程,设计以F为原料制备G的合成路线:
 ________________________(无机试剂任选)。
________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol/LNaOH溶液中,逐滴加入10 mL浓度为c mol/L的HF稀溶液。已知 25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ/mol ②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。请根据信息判断,下列说法中不正确的是
A.整个滴加过程中,水的电离程度不一定存在先增大后减小的变化趋势
B.将氢氟酸溶液温度由25℃升高到35℃时,HF的电离程度减小(不考虑挥发)
C.当c>0.1时,溶液中才有可能存在c(Na+)=c(F-)
D.若滴定过程中存在:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com