
| A. | 改变温度,当产物中NaClO3的物质的量最大时,发生的离子反应为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O | |
| B. | 某温度下,反应后若溶液中c(ClO-):c(ClO3-)=1:2,发生的离子反应为:7Cl2+14OH-$\frac{\underline{\;\;△\;\;}}{\;}$11Cl-+ClO-+2ClO3-+7H2O | |
| C. | 参加反应的Cl2与NaOH的物质的量的关系一定是a=0.5b | |
| D. | 改变温度,反应中转移电子的物质的量可能为b mol |
分析 氯气和氢氧化钠恰好反应生成NaCl、NaClO及NaClO3,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),再根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),根据转移电子守恒得n(C1-)=n(ClO-)+5n(ClO3-),
A.当产物中NaClO3的物质的量最大时即只生成NaCl和NaClO3,所以根据转移电子守恒得n(C1-)=5n(ClO3-),据此书写离子方程式;
B.某温度下,反应后若溶液中c(ClO-):c(ClO3-)=1:2,根据转移电子守恒得n(C1-)=n(ClO-)+5n(ClO3-),所以c(C1-)=11,据此书写离子方程式;
C.根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),氯原子守恒2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)判断;
D.利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,氧化产物只有NaClO3,转移电子数最多.
解答 解:A.根当产物中NaClO3的物质的量最大时即只生成NaCl和NaClO3,所以根据转移电子守恒得n(C1-)=5n(ClO3-),则发生的离子反应为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O,故A正确;
B.某温度下,反应后若溶液中c(ClO-):c(ClO3-)=1:2,根据转移电子守恒得n(C1-)=n(ClO-)+5n(ClO3-),所以c(C1-)=11,所以发生的离子反应为:7Cl2+14OH-$\frac{\underline{\;\;△\;\;}}{\;}$11Cl-+ClO-+2ClO3-+7H2O,故B正确;
C.钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),故参加反应的Cl2与NaOH的物质的量的关系一定是a=0.5b,故C正确;
D.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为b×$\frac{1}{2}$mol×1=0.5bmol,氧化产物只有NaClO3,转移电子数最多,为b×$\frac{1}{2}$mol×$\frac{5}{6}$=$\frac{5}{12}$bmol,则反应中转移电子的物质的量不可能为b mol,故D错误;
故选D.
点评 本题考查了氧化还原反应的有关计算,根据原子守恒及转移电子守恒是解本题关键,并结合极限法分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠显示了强还原性 | B. | 二氧化碳是酸性氧化物 | ||
| C. | 金属钠熔点较低 | D. | 二氧化碳也能起助燃作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NaOH)>c(NH3•H2O) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的NaOH与NH3•H2O溶液分别与足量的Si完全反应,NH3•H2O产生的H2多 | |
| D. | 用相同浓度的盐酸溶液分别与等体积的NaOH与NH3•H2O溶液恰好反应完全,NaOH消耗的盐酸溶液体积多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
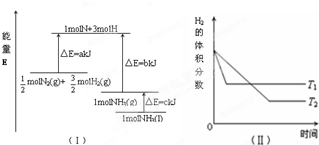
| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图M所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图M所示,对该反应的推断合理的是( )| A. | M点表示v(A)=v(B) | |
| B. | 0~6s内,v(A):v(B):v(C):v(D)=3:1:1.5:2 | |
| C. | 反应进行到6s时,各物质的物质的量浓度相等 | |
| D. | 反应进行到6s时,C的平均反应速率为 0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-═SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com