
【题目】2019年2月,在世界移动通信大会(MWC)上,发布了中国制造首款5G折叠屏手机的消息。手机电池的工作原理是LiCoO2+C=Li1-xCoO2+LixC 下列说法不正确的是( )

A.制造手机芯片的关键材料硅,是非金属元素
B.用铜制作的手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.这种手机电池工作时,没有氧化还原反应发生
科目:高中化学 来源: 题型:
【题目】KMnO4在医疗上有广泛地应用,可用于防腐、制药、消毒等。现以软锰矿(主要成分为MnO2,含有少量Al2O3、SiO2等)为原料制备KMnO4的工业流程如图所示。

(1)料渣的主要成分是____,操作2的意义是__________。
(2)“调pH”的目的是__________;写出“氧化”过程中发生反应的离子方程式:________;熔融过程中,氧化剂与还原剂的物质的量之比为_______。
(3)操作3的内容为蒸发浓缩、趁热过滤、洗涤、烘干,已知KHCO3、KMnO4的溶解度曲线是下图中的两种,则KHCO3、KMnO4的溶解度曲线分别是_____(填序号)。

(4)用惰性电极电解K2MnO4溶液也可得到目标产物,则生成目标产物的电极反应式为___________,充分电解后,得到的溶液中溶质的主要成分是______和KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理.___________________________________________
(2)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
___________________________________
(3)取少量Fe2O3粉末(红棕色)加入适量盐酸,该反应的离子方程式为______________________;用此溶液进行以下反应,取少量溶液于一支试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
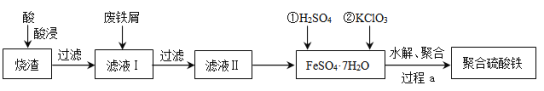
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500 ℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25 ℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1____(填“>”“<”或“=”)T2,T2时Ksp(BaSO4)=______。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是____(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为____ mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

请回答下列问题。
(1)硬质试管中发生的化学方程式___________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管中固体物质一定有_________,可能有_________(填写“化学式”),若溶液未变红色,则说明硬质试管中固体物质的成分是___________________(填写“化学式”)。

(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:______(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述白色沉淀变成红褐色的反应的化学方程式____________________________。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有_____性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是_________,并且配制含Fe2+的盐溶液时应加入少量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某栏目报道一超市在售的鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,该是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多的棉酚所致。已知棉酚的结构简式如图所示,下列说法正确的是
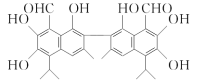
A.棉酚的一氯代物有3种B.棉酚能与溴水发生加成反应
C.1mol棉酚最多与10mol H2反应D.1mol棉酚最多与6 molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com