
【题目】T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1____(填“>”“<”或“=”)T2,T2时Ksp(BaSO4)=______。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是____(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为____ mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_______________________。
【答案】< ![]() ABC 对于沉淀溶解平衡
ABC 对于沉淀溶解平衡![]() ,
,![]() 不能减少
不能减少![]() 或
或![]() 的浓度,平衡不能向溶解方向移动
的浓度,平衡不能向溶解方向移动 ![]()
![]()
【解析】
(1)沉淀溶解平衡是吸热反应,升高温度,平衡向右移动,即温度越高![]() 的溶解度越大,
的溶解度越大,![]() 温度下的离子积较小,所以
温度下的离子积较小,所以![]() ;
;![]() 时Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.0×10-4mol/L×5.0×10-5mol/L=5.0×10-9mol2/L2;
时Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.0×10-4mol/L×5.0×10-5mol/L=5.0×10-9mol2/L2;
(2)A、由于存在溶解平衡,加入![]() ,
,![]() 浓度增大,
浓度增大,![]() 的沉淀溶解平衡逆向移动,
的沉淀溶解平衡逆向移动,![]() 的浓度降低,a点会变为b点,故正确;
的浓度降低,a点会变为b点,故正确;
B、![]() 曲线上方区域的离子积大于溶度积,所以会析出沉淀,故正确;
曲线上方区域的离子积大于溶度积,所以会析出沉淀,故正确;
C、蒸发溶剂,不饱和溶液中![]() 和
和![]() 的浓度都变大,可能由d点变为
的浓度都变大,可能由d点变为![]() 曲线上a、b之间的某一点,故正确;
曲线上a、b之间的某一点,故正确;
D、升高温度,平衡向沉淀溶解方向移动,c(Ba2+),c(SO42-)会变大,故错误;
故选ABC;
(3)①由沉淀溶解平衡![]() 可知,
可知,![]() 不能减小
不能减小![]() 或
或![]() 的浓度,平衡不能向溶解方向移动;
的浓度,平衡不能向溶解方向移动;
根据Ksp(BaSO4)=c(Ba2+)c(SO42-),c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=![]() =2×10-10mol/L;
=2×10-10mol/L;
②由平衡![]() 可知,加入
可知,加入![]() 溶液后,
溶液后,![]() 与
与![]() 结合生成
结合生成![]() 沉淀
沉淀![]() 浓度减少,使
浓度减少,使![]() 的沉淀溶解平衡向溶解方向移动,发生
的沉淀溶解平衡向溶解方向移动,发生![]() 。
。
故答案为:对于沉淀溶解平衡![]() ,
,![]() 不能减少
不能减少![]() 或
或![]() 的浓度,平衡不能向溶解方向移动;
的浓度,平衡不能向溶解方向移动;![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态K原子中,核外电子排布图是_________,占据最高能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________。
(3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化类型为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________,B的正确读数为________。

(2)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(3)判断滴定终点的现象是________________________________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/L NH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月,在世界移动通信大会(MWC)上,发布了中国制造首款5G折叠屏手机的消息。手机电池的工作原理是LiCoO2+C=Li1-xCoO2+LixC 下列说法不正确的是( )

A.制造手机芯片的关键材料硅,是非金属元素
B.用铜制作的手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.这种手机电池工作时,没有氧化还原反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 molL-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____________。
②下列操作对实验结果的影响偏高的是____________(填序号)。
a.加水定容时俯视刻度线
b.未洗涤溶解后的烧杯和玻璃棒
c.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和_____________。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_________。(填氧化性、还原性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
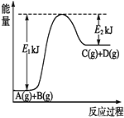
(1)该反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=________kJ/mol (用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量______(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1_______,E2________ΔH______ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[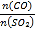 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
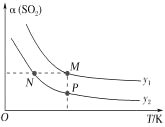
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )
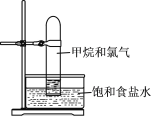
A.试管中气体颜色变浅
B.试管内液面慢慢上升
C.水槽中的液体溶有氯化氢
D.试管内壁的油滴是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.在一定温度和压强下,各种气态物质体积大小由分子间距离决定
B.相同温度时,CO2和N2O若体积相同,则它们的质量一定相同
C.100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L
D.14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com