
【题目】通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )
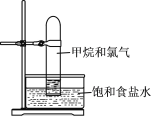
A.试管中气体颜色变浅
B.试管内液面慢慢上升
C.水槽中的液体溶有氯化氢
D.试管内壁的油滴是纯净物
科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是( )
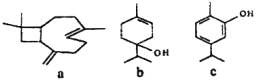
A. a、b、c均能使酸性KMnO4溶液褪色
B. a、b中均含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
C. b、c均能发生加成反应、还原反应、取代反应、消去反应
D. c分子中所有碳原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较氧元素和氟元素的非金属性强弱:O_______F(填“<”“>或”“=”);用一个化学方程式说明两者非金属的相对强弱______________________________________。
(2)2002年1月18日在《科学》期刊中报导罗马大学的Fulvio Cacace及其同事发现氮的一种同素异形体N4,已知N4所有原子均满足8电子稳定结构。写出N4的结构式_______________。
(3)CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:
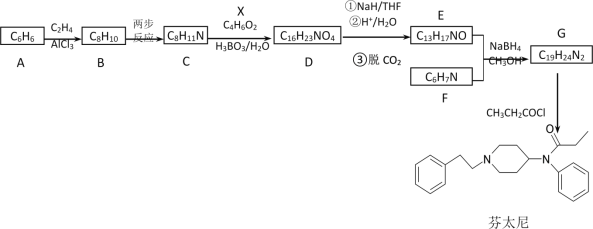
已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,一定容积的密闭容器中,发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A. 25℃达到平衡时,向容器中继续通入CO,Ni粉转化率增大,CO转化率减小
B. 温度越低,越有利于Ni(CO)4的生产
C. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)<v(逆)
D. 平衡时向密闭容器中加入少量镍粉,平衡向正反应方向移动,新平衡时CO浓度比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
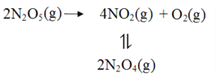
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海南粗榧新碱具有抗肿瘤、抗炎等作用,其中间体G的合成线路如图:
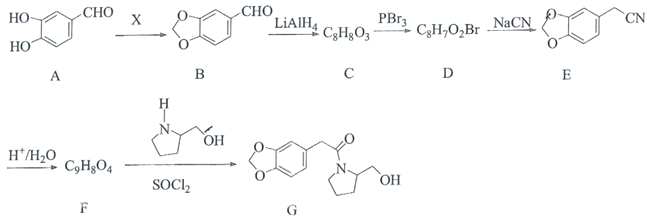
已知:
①R-COOH+R′-NH2![]()
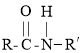 +H2O;
+H2O;
②R-CN![]()
![]()
回答下列问题:
(1)X为醛类物质,其名称为________,C中含氧官能团的名称为________。
(2)C→D的反应类型为________。
(3)化合物F的结构简式为________。
(4)B与新制的氢氧化铜悬浊液反应的化学方程式为________。
(5)有机物Y是A的同分异构体,满足条件:①能与![]() 溶液发生显色反应,②
溶液发生显色反应,②![]() 与足量金属Na反应生成
与足量金属Na反应生成![]() ,③结构中含“
,③结构中含“![]() ”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为
”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为![]() 的物质为________(写出其中一种结构简式)。
的物质为________(写出其中一种结构简式)。
(6)设计以![]() 为起始原料制备
为起始原料制备![]() 的合成线路(无机试剂任选) ________。
的合成线路(无机试剂任选) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁的含量在地球金属元素中处于前两位,它们的单质及化合物应用非常广泛。
(1)铁酸钠(Na2FeO4)是一种新型净水剂,制取原理如下:Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O
配平上述化学方程式_____。
(2)工业上利用Fe2O3和CO反应制取铁,在一定温度下,反应如下:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为K=_____。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g,则10min内CO的平均反应速率为_____。
③请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:_____。
a.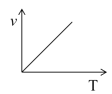 b.
b.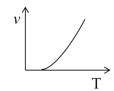 c.
c. d.
d.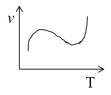
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是______。
(4)实验室通常用硫酸铝溶液和氨水反应制备Al(OH)3,写出该反应的离子方程式_____。如果用硫酸铝溶液和氢氧化钠溶液反应,能否制得Al(OH)3,简要说明原因_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com