
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:
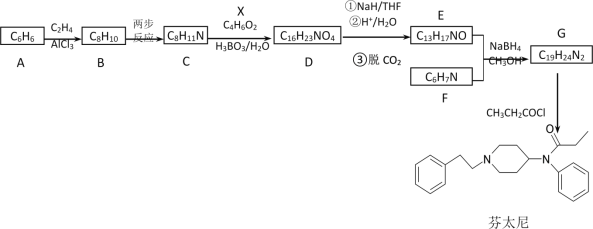
已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
【答案】BD CH2=CHCOOCH3 
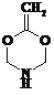 、
、 、
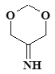
、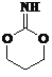 、
、
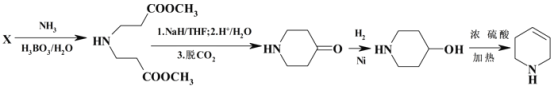
【解析】
根据分子式及芬太尼结构简式可知A为![]() ;A和C2H4的C原子、H原子相加刚好为B的分子式(C8H10),则A到B为加成反应,B为
;A和C2H4的C原子、H原子相加刚好为B的分子式(C8H10),则A到B为加成反应,B为![]() ;由已知信息①及C的分子式可知C为:
;由已知信息①及C的分子式可知C为:![]() ;结合信息②和D到E可知,D含2个酯基,那么X含酯基,由于D到E碳原子少了三个,倒推X必为CH2=CHCOOCH3,结合信息③得出,D为
;结合信息②和D到E可知,D含2个酯基,那么X含酯基,由于D到E碳原子少了三个,倒推X必为CH2=CHCOOCH3,结合信息③得出,D为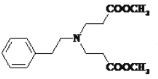 ;D到E发生信息②所示反应生成
;D到E发生信息②所示反应生成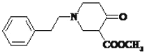 ,
, 在酸性条件下水解得到
在酸性条件下水解得到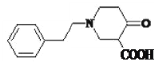 ,
, 中羧基脱CO2生成E,E为:
中羧基脱CO2生成E,E为: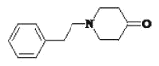 ;由F分子式可知,F为:
;由F分子式可知,F为: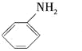 ,结合E、F、G的分子式可知,E和F发生加成反应生成G,G为:
,结合E、F、G的分子式可知,E和F发生加成反应生成G,G为: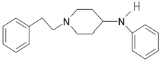 ,
,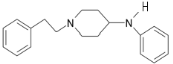 和CH3CH2COCl发生取代反应生成芬太尼
和CH3CH2COCl发生取代反应生成芬太尼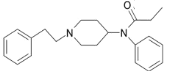 ,据此解答。
,据此解答。
(1)A.B(![]() )和氯气在光照条件下发生取代反应生成
)和氯气在光照条件下发生取代反应生成![]() ,
,![]() 和NH3在碱性条件下发生取代反应生成C(
和NH3在碱性条件下发生取代反应生成C(![]() ),故B到C发生了两步取代反应,A错误;
),故B到C发生了两步取代反应,A错误;
B.C(![]() )的官能团为-NH2,有碱性,能与盐酸反应生成盐,B正确;
)的官能团为-NH2,有碱性,能与盐酸反应生成盐,B正确;
C.A(![]() )和浓硫酸、浓硝酸共热到55℃—60℃生成
)和浓硫酸、浓硝酸共热到55℃—60℃生成![]() ,
,![]() 还原得到
还原得到 ,需要2步,C错误;
,需要2步,C错误;
D.芬太尼的分子式是C22H28N2O,D正确;
综上所述,BD正确,故答案为:BD;
(2)由分析可知,X为:CH2=CHCOOCH3,故答案为:CH2=CHCOOCH3;
(3)D( )在NaH/THF作用下发生的反应为:
)在NaH/THF作用下发生的反应为: ,故答案为:
,故答案为: ;
;
(4)X为 CH2=CHCOOCH3,含2个不饱和度,Y(C4H7O2N)比X多1个N、一个H,则Y的不饱和度也为2,分子中有一个六元环,则必有一个双键,又因为只有三种H,则2个O必然对称,即2个O在环上且对称才能满足条件,所以,满足条件的结构有: 、
、 、
、 、
、 ,故答案为:
,故答案为: 、
、 、
、 、
、 ;
;
(5)逆合成目标产物![]() 可由
可由![]() 发生消去反应而来,
发生消去反应而来,![]() 可由
可由![]() 加氢还原而来,
加氢还原而来,![]() 和题目流程中E对应,可由
和题目流程中E对应,可由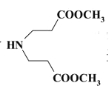 发生类似D到E的反应而来,
发生类似D到E的反应而来, 由NH3和X(CH2=CHCOOCH3)发生类似信息③的反应而来,综上所述:
由NH3和X(CH2=CHCOOCH3)发生类似信息③的反应而来,综上所述: ,故答案为:
,故答案为: 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】镓(31Ga)是化学史上第一个先从理论上被预言,后在自然界被发现的元素。Ga与K同周期。下列说法不正确的是
A.Ga在周期表中的位置:第四周期第ⅢA族
B.原子半径:Ga > K
C.中子数为36的Ga的核素:![]()
D.最高价氧化物对应水化物的碱性:Ga(OH)3>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.12g金刚石和石墨的混合物中,碳原子数为NA
B.2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O,则每生成1 mol O2转移电子数为2NA
C.已知H3PO2+OH(足量)= ![]() +H2O,说明1 mol H3PO2电离出H+数为NA
+H2O,说明1 mol H3PO2电离出H+数为NA
D.标准状况下,11.2 L乙烷和苯的混合物中C-H数目为 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、__________以及等质量的几片滤纸。
(2) 计算。配制该溶液需称取NaCl晶体的质量为__________g。
(3)称量。
![]()
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置______:
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,把药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(5)转移、洗涤。在转移时应使用_________ _引流,洗涤烧杯2~3次是为了__________。
(6)定容,摇匀。定容操作为__________________。
(7)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会_________。
③定容时俯视,浓度会_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产![]() 的过程中完成乙烯氯化,下列叙述错误的是( )
的过程中完成乙烯氯化,下列叙述错误的是( )
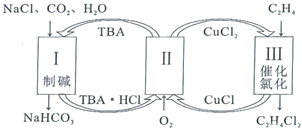
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、![]() 的再生
的再生
C.理论上每生成![]() ,可得到
,可得到![]()
D.过程Ⅲ中的反应是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )
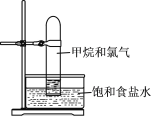
A.试管中气体颜色变浅
B.试管内液面慢慢上升
C.水槽中的液体溶有氯化氢
D.试管内壁的油滴是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
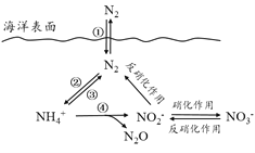
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
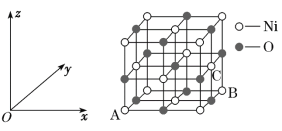
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为__。
(2)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是__。
(3)铁氰化钾{K3[Fe(CN)6])}溶液是检验Fe2+常用的试剂。lmol[Fe(CN)6]3-含σ键的数目为__。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是__。配体N3-中心原子的杂化类型为__。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因__。
(5)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com