
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、__________以及等质量的几片滤纸。
(2) 计算。配制该溶液需称取NaCl晶体的质量为__________g。
(3)称量。
![]()
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置______:
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,把药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(5)转移、洗涤。在转移时应使用_________ _引流,洗涤烧杯2~3次是为了__________。
(6)定容,摇匀。定容操作为__________________。
(7)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会_________。
③定容时俯视,浓度会_________。
【答案】500ml容量瓶 胶头滴管 14.6 ![]() 左盘 搅拌 加快溶解 使溶质都进入容量瓶 当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切 偏小 无影响 偏大
左盘 搅拌 加快溶解 使溶质都进入容量瓶 当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切 偏小 无影响 偏大
【解析】
考查一定物质的量浓度溶液的配制的实验过程,包括计算、称量、溶解、转移、洗涤、定容等。再根据![]() ,判断误差分析。
,判断误差分析。
(1)配制一定物质的量浓度的溶液时,需要使用到容量瓶,配制480mL溶液,实验室中没有480mL的容量瓶,应该选用500mL容量瓶,定容时,需要使用到胶头滴管;
(2)实验室没有480mL的容量瓶,配制时要使用500mL的容量瓶,因此计算NaCl的质量时,也需要按照500mL计算。需要NaCl的物质的量为0.50 mol·L-1 ×0.5L=0.25mol,则NaCl的质量为0.25mol×58.5g·mol-1=14.625g,托盘天平的精确度为0.1g,因此称量NaCl的质量为14.6g;
(3)①如果砝码可以称量到1g,那么游码应该到0.6g,则游码的位置在0.6的位置,如图![]() ;
;
②使用托盘天平称量时,物品应该放在左盘进行称量;
(4)溶解时,使用玻璃棒用于搅拌,加速溶解;
(5)引流时,需要使用玻璃棒;洗涤玻璃棒和烧杯2~3次,全部转移到容量瓶中,是为了将所有溶质转移至容量瓶中;
(6)定容时,需要加入蒸馏水,使凹液面的最低处与刻度线相平,答案为:当液面距刻度线1-2 cm处时,用胶头滴管加水到液面的凹液面的最低处与刻度相切;
(7)①未洗涤烧杯和玻璃棒,有部分溶质没有转移至容量瓶中,浓度偏小;
②容量瓶中有少量蒸馏水,在后续操作中也需要往容量瓶中加入蒸馏水,本来就有蒸馏水,不会带浓度带来误差;
③定容时,俯视刻度线,水加少了,体积偏小,浓度偏大。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 正四面体烷![]() 与立方烷
与立方烷![]() 的二氯代物数目相同
的二氯代物数目相同
B. 淀粉的水解产物为葡萄糖,葡萄糖在酒化酶作用下再进一步水解可得酒精
C. 75%的乙醇溶液可用于医疗消毒,福尔马林可用于浸制动物标本,二者都使蛋白质变 性
D. 甘氨酸和丙氨酸混合物发生缩合只能形成 2 种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
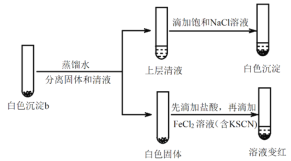
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较氧元素和氟元素的非金属性强弱:O_______F(填“<”“>或”“=”);用一个化学方程式说明两者非金属的相对强弱______________________________________。
(2)2002年1月18日在《科学》期刊中报导罗马大学的Fulvio Cacace及其同事发现氮的一种同素异形体N4,已知N4所有原子均满足8电子稳定结构。写出N4的结构式_______________。
(3)CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
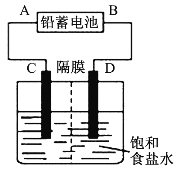
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
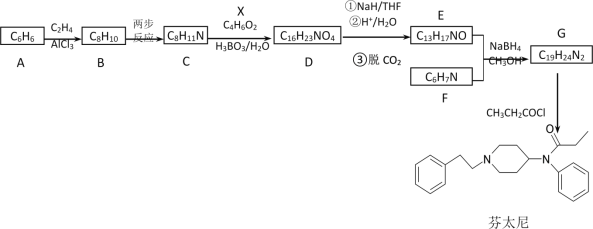
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:
已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com