
【题目】(1)比较氧元素和氟元素的非金属性强弱:O_______F(填“<”“>或”“=”);用一个化学方程式说明两者非金属的相对强弱______________________________________。
(2)2002年1月18日在《科学》期刊中报导罗马大学的Fulvio Cacace及其同事发现氮的一种同素异形体N4,已知N4所有原子均满足8电子稳定结构。写出N4的结构式_______________。
(3)CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因_______________________________________________。
【答案】< 2F2+2H2O=4HF+O2 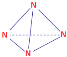 两者的结构不同,SiO2为原子晶体,CO2是分子晶体。
两者的结构不同,SiO2为原子晶体,CO2是分子晶体。
【解析】
(1)F是非金属性最强的元素,二者的非金属性强弱关系,可通过比较二者单质的氧化性来比较,即F2的氧化性比O2强,F2可以置换O2,方程式为:2F2+2H2O=4HF+O2,故答案为:<;2F2+2H2O=4HF+O2;
(2) N4所有原子均满足8电子稳定结构,则每个N原子都要与另外3个N原子相连,则N4必为正四面体结构,N原子在正四面体的顶点处,即N4的结构式为: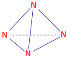 ,故答案为:
,故答案为: ;
;
(3)二者结构不同,CO2是分子晶体,SiO2是原子晶体,CO2熔化要克服分子间作用力,SiO2熔化要克服共价键,共价键比分子间作用力强,所以,SiO2的熔点比CO2高,故答案为:两者的结构不同,SiO2为原子晶体,CO2是分子晶体。


科目:高中化学 来源: 题型:
【题目】Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _____________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是_________________ | ___________ |
③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是______________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是三种常见有机物的比例模型,回答以下问题。
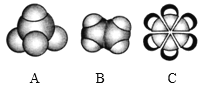
(1)A分子的空间构型为_____;B的结构式为_____;C的分子式为_____。
(2)将B气体通入酸性高锰酸钾溶液中,观察到的现象为_____;将B气体通入溴的四氯化碳溶液中,写出该反应的化学方程式_____。
(3)A的同系物D有5个碳原子,其分子式为_____;写出D所有同分异构体的结构简式:_____;_____;_____。
(4)C分子中不存在碳碳单键与碳碳双键交替的结构,下列实验的结果可以作为证据的是_____(填序号)
①将苯滴入酸性高锰酸钾溶液,振荡,看是否褪色;
②经测定,苯环上碳碳键的键长相等,都是1.40×10-10m
③苯在一定条件下既能发生取代反应,又能发生加成反应
④将苯滴入溴的四氯化碳溶液,振荡,看是否褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.12g金刚石和石墨的混合物中,碳原子数为NA
B.2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O,则每生成1 mol O2转移电子数为2NA
C.已知H3PO2+OH(足量)= ![]() +H2O,说明1 mol H3PO2电离出H+数为NA
+H2O,说明1 mol H3PO2电离出H+数为NA
D.标准状况下,11.2 L乙烷和苯的混合物中C-H数目为 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用废铁屑(主要成分为Fe2O3、Fe,少量碳) 制取碳酸亚铁(FeCO3) ,设计了如下流程:
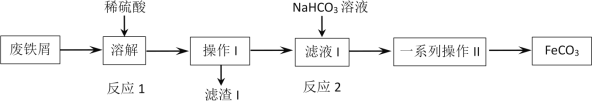
根据以上流程图,下列说法不正确的是( )
A.工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去
B.反应2的离子方程式:Fe2++HCO3- = FeCO3↓+H+
C.操作I为过滤,洗涤操作,一系列操作II为过滤,洗涤,干燥
D.为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、__________以及等质量的几片滤纸。
(2) 计算。配制该溶液需称取NaCl晶体的质量为__________g。
(3)称量。
![]()
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置______:
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,把药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(5)转移、洗涤。在转移时应使用_________ _引流,洗涤烧杯2~3次是为了__________。
(6)定容,摇匀。定容操作为__________________。
(7)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会_________。
③定容时俯视,浓度会_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过排饱和食盐水,用大试管收集体积比为1∶1的甲烷和氯气混合气(如图),强光照射下发生反应。下列说法错误的是( )
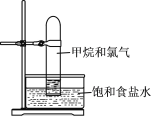
A.试管中气体颜色变浅
B.试管内液面慢慢上升
C.水槽中的液体溶有氯化氢
D.试管内壁的油滴是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持装置已省略)和有关信息如下:
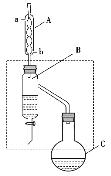
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
A.加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加入即可
B.装置B的作用是不断分离出乙酸丁酯,提高产率
C.装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出
D.乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com