
【题目】如图是三种常见有机物的比例模型,回答以下问题。
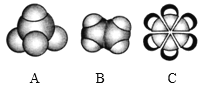
(1)A分子的空间构型为_____;B的结构式为_____;C的分子式为_____。
(2)将B气体通入酸性高锰酸钾溶液中,观察到的现象为_____;将B气体通入溴的四氯化碳溶液中,写出该反应的化学方程式_____。
(3)A的同系物D有5个碳原子,其分子式为_____;写出D所有同分异构体的结构简式:_____;_____;_____。
(4)C分子中不存在碳碳单键与碳碳双键交替的结构,下列实验的结果可以作为证据的是_____(填序号)
①将苯滴入酸性高锰酸钾溶液,振荡,看是否褪色;
②经测定,苯环上碳碳键的键长相等,都是1.40×10-10m
③苯在一定条件下既能发生取代反应,又能发生加成反应
④将苯滴入溴的四氯化碳溶液,振荡,看是否褪色
【答案】正四面体 ![]() C6H6 溶液褪色 CH2= CH2+Br2→CH2 BrCH2Br C5H12 CH3CH2CH2CH2CH3
C6H6 溶液褪色 CH2= CH2+Br2→CH2 BrCH2Br C5H12 CH3CH2CH2CH2CH3 ![]()
 ①②④
①②④
【解析】
根据比例模型知,A是甲烷、B是乙烯、C是苯,甲烷是正四面体结构,乙烯和苯都是平面结构,乙烯能被酸性高锰酸钾氧化,能与溴单质发生加成反应,本结构中不存在存在碳碳单键与碳碳双键交替的结构。
根据比例模型知,A是甲烷、B是乙烯、C是苯,
(1)A是甲烷,为正四面体结构,B是乙烯,乙烯分子中含有1个碳碳双键和4个碳氢键,其结构式为![]() ,C是苯,分子式为C6H6,故答案为:正四面体;
,C是苯,分子式为C6H6,故答案为:正四面体;![]() ;C6H6;
;C6H6;
(2)乙烯气体通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液会褪色,将乙烯气体通入溴的四氯化碳溶液中,发生加成反应,反应的化学方程式:CH2= CH2+Br2→CH2BrCH2Br;;故答案为:溶液褪色;CH2= CH2+Br2→CH2BrCH2Br;
(3)甲烷的同系物有5个碳原子,为C5H12,有三种同分异构体:CH3CH2CH2CH2CH3、![]() 、
、 ,故答案为:C5H12;CH3CH2CH2CH2CH3;
,故答案为:C5H12;CH3CH2CH2CH2CH3;![]() ;
; ;
;
(4)①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故①正确;
②苯环上碳碳键的键长相等,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故②正确;
③苯能在一定条件下跟H2加成生成环己烷,发生加成反应是双键具有的性质,不能证明苯环结构中不存在C-C单键与C=C双键的交替结构,故③错误;
④将苯滴入溴的四氯化碳溶液,振荡,苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故④正确。
故答案为:①②④。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
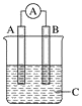
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了含 N![]() 的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
的五氮阴离子盐,这是全氮含能材料研究领域中里程碑式的突破。
(1)N![]() 中,N 原子之间的相互作用是_____(填“离子键”或“共价键”)。
中,N 原子之间的相互作用是_____(填“离子键”或“共价键”)。
(2)砷(As)与氮位于同一主族,下列推断正确的是_____(填序号)。
① 砷元素的最低负化合价为3 价 ② 砷的最高价氧化物对应的水化物属于酸 ③ 热稳定性:AsH3>NH3
(3)非金属性O 强于N,用原子结构解释原因:_____,得电子能力O 大于N。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是( )
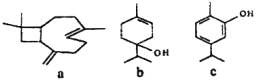
A. a、b、c均能使酸性KMnO4溶液褪色
B. a、b中均含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
C. b、c均能发生加成反应、还原反应、取代反应、消去反应
D. c分子中所有碳原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚 乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家 近年来合成的聚乙炔衍生物分子 M 的结构式及 M 在稀硫酸作用下的水解过程。
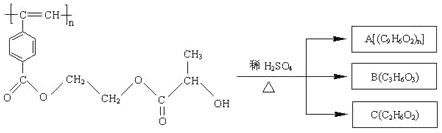
下列有关说法中不正确的是
A. M 与 A 均能使酸性高锰酸钾溶液和溴水褪色
B. B 中含有两种官能团,B 能发生消去反应和缩聚反应
C. A、B、C 各 1 mol 分别不足量金属钠反应,放出的气体的物质的量之比为 1∶2∶2
D. 1 mol M 与热的烧碱溶液反应,可消耗 2n mol 的 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
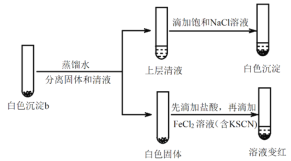
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原 料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为:
![]() +CH3COOH
+CH3COOH![]() +H2O
+H2O

注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉0.1 g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃ 左右,反应约 60~80 min,反应生成的水及少量醋酸被蒸出。 步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有 100 mL 冰 水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰 苯胺粗品。步骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤 1 中所选圆底烧瓶的最佳规格是_________(填序号)。
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是___________________________________________________________________________。
(3)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因____________________________________________________________________________。
(4)洗涤乙酰苯胺粗品最合适的方法是_____(填序号)。
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
_______________、过滤、洗涤、干燥(选则正确的操作并排序)。
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品 8.1g,则乙酰苯胺的产率是______________ %。
(7)如图的装置有 1 处错误,请指出错误之处____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较氧元素和氟元素的非金属性强弱:O_______F(填“<”“>或”“=”);用一个化学方程式说明两者非金属的相对强弱______________________________________。
(2)2002年1月18日在《科学》期刊中报导罗马大学的Fulvio Cacace及其同事发现氮的一种同素异形体N4,已知N4所有原子均满足8电子稳定结构。写出N4的结构式_______________。
(3)CO2和SiO2均是IVA族元素氧化物,CO2常温为气态,SiO2为高熔点固体。请分析原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
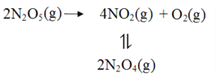
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com