
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
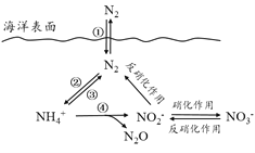
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
【答案】② ad 4 6 N2O 5H2O
【解析】
(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程,即单质变化为化合物,反应②是氮气转化为铵根离子属于氮的固定;
(2)a.据图可知海洋中溶有部分氮气分子,即海洋中存在游离态的氮,故a正确;
b.据图可知海洋中的氮循环起始于N2转化为铵根,氮元素化合价降低,为氮的还原,故b错误;
c.反硝化过程中N元素的化合价降低,被还原,而氧气一般作为氧化剂参与反应,所以反硝化过程没有氧气参与,故c错误;
d.转化关系图中硝酸根离子增多,反硝化作用增强,从而使铵根的含量升高,故d正确;
综上所述选ad;
(3)![]() 转化为
转化为![]() 化合价升高+6价,生成2个
化合价升高+6价,生成2个![]() 失去12个电子;氧气作氧化剂一般被还原成-2价,所以5个O2可以得到20个电子,根据电子守恒可知
失去12个电子;氧气作氧化剂一般被还原成-2价,所以5个O2可以得到20个电子,根据电子守恒可知![]() 还应再失去8个电子,据图可知还有N2O生成,该过程N元素化合价生成4价,则需要生成1个N2O才能使得失电子守恒,再结合元素守恒可得方程式为4
还应再失去8个电子,据图可知还有N2O生成,该过程N元素化合价生成4价,则需要生成1个N2O才能使得失电子守恒,再结合元素守恒可得方程式为4![]() +5O2==2
+5O2==2![]() +6H++N2O+5H2O。
+6H++N2O+5H2O。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
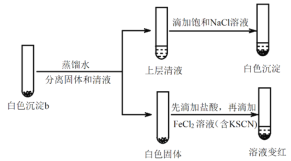
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
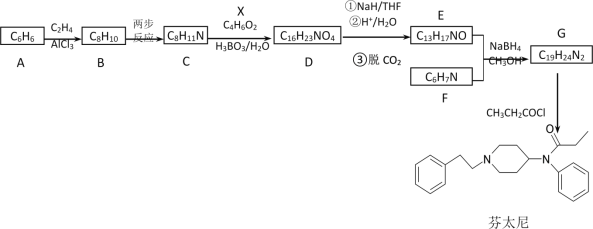
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:
已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
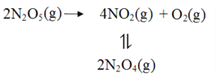
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海南粗榧新碱具有抗肿瘤、抗炎等作用,其中间体G的合成线路如图:
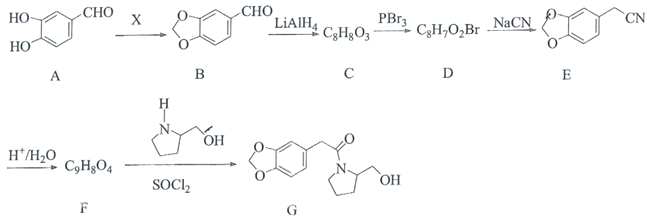
已知:
①R-COOH+R′-NH2![]()
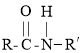 +H2O;
+H2O;
②R-CN![]()
![]()
回答下列问题:
(1)X为醛类物质,其名称为________,C中含氧官能团的名称为________。
(2)C→D的反应类型为________。
(3)化合物F的结构简式为________。
(4)B与新制的氢氧化铜悬浊液反应的化学方程式为________。
(5)有机物Y是A的同分异构体,满足条件:①能与![]() 溶液发生显色反应,②
溶液发生显色反应,②![]() 与足量金属Na反应生成
与足量金属Na反应生成![]() ,③结构中含“
,③结构中含“![]() ”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为
”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为![]() 的物质为________(写出其中一种结构简式)。
的物质为________(写出其中一种结构简式)。
(6)设计以![]() 为起始原料制备
为起始原料制备![]() 的合成线路(无机试剂任选) ________。
的合成线路(无机试剂任选) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是

A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com