
ЁОЬтФПЁПКЃФЯДжщМаТМюОпгаПЙжзСіЁЂПЙбзЕШзїгУЃЌЦфжаМфЬхGЕФКЯГЩЯпТЗШчЭМЃК
вбжЊЃК
ЂйR-COOH+RЁф-NH2![]()
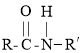 +H2OЃЛ
+H2OЃЛ
ЂкR-CN![]()
![]()
ЛиД№ЯТСаЮЪЬтЃК
(1)XЮЊШЉРрЮяжЪЃЌЦфУћГЦЮЊ________ЃЌCжаКЌбѕЙйФмЭХЕФУћГЦЮЊ________ЁЃ
(2)CЁњDЕФЗДгІРраЭЮЊ________ЁЃ
(3)ЛЏКЯЮяFЕФНсЙЙМђЪНЮЊ________ЁЃ
(4)BгыаТжЦЕФЧтбѕЛЏЭаќзЧвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
(5)гаЛњЮяYЪЧAЕФЭЌЗжвьЙЙЬхЃЌТњзуЬѕМўЃКЂйФмгы![]() ШмвКЗЂЩњЯдЩЋЗДгІЃЌЂк
ШмвКЗЂЩњЯдЩЋЗДгІЃЌЂк![]() гызуСПН№ЪєNaЗДгІЩњГЩ
гызуСПН№ЪєNaЗДгІЩњГЩ![]() ЃЌЂлНсЙЙжаКЌЁА
ЃЌЂлНсЙЙжаКЌЁА![]() ЁБЃЌYЙВга________жжЃЌЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЧвЗхУцЛ§БШЮЊ
ЁБЃЌYЙВга________жжЃЌЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЧвЗхУцЛ§БШЮЊ![]() ЕФЮяжЪЮЊ________(аДГіЦфжавЛжжНсЙЙМђЪН)ЁЃ
ЕФЮяжЪЮЊ________(аДГіЦфжавЛжжНсЙЙМђЪН)ЁЃ
(6)ЩшМЦвд![]() ЮЊЦ№ЪМдСЯжЦБИ
ЮЊЦ№ЪМдСЯжЦБИ![]() ЕФКЯГЩЯпТЗ(ЮоЛњЪдМСШЮбЁ) ________ЁЃ
ЕФКЯГЩЯпТЗ(ЮоЛњЪдМСШЮбЁ) ________ЁЃ
ЁОД№АИЁПМзШЉ єЧЛљЁЂУбМќ ШЁДњЗДгІ ![]()
 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2OЁ§+3H2O 8
+Cu2OЁ§+3H2O 8 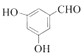 Лђ
Лђ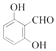 Лђ
Лђ![]()
ЁОНтЮіЁП
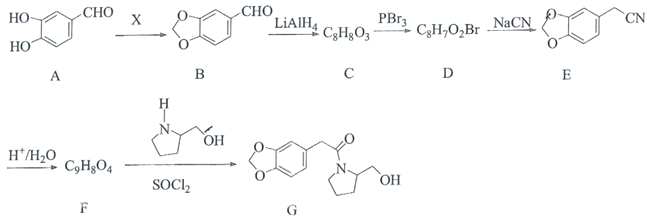
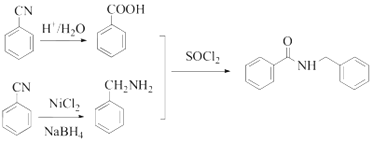
AгыXЗДгІЩњГЩBЃЌНсКЯAгыBЕФНсЙЙМђЪНЃЌПЩЕУXЮЊМзШЉЃЌBдкLiAlH4ЕФзїгУЯТЩњГЩCЃЌCМгШыPBr3ПЩвдЕУЕНDЃЌDМгШыЧшЛЏФЦКѓЕУЕНEЃЌЫсЛЏКѓЕУЕНFЃЌНсКЯBКЭEЕФНсЙЙМђЪНЃЌКЭCЁЂDЕФЗжзгЪНЃЌПЩЕУCЕФНсЙЙМђЪНЮЊ![]() ЃЌDЕФНсЙЙМђЪНЮЊ
ЃЌDЕФНсЙЙМђЪНЮЊ![]() ЃЌFЕФНсЙЙМђЪНЮЊ
ЃЌFЕФНсЙЙМђЪНЮЊ![]() ЃЌFгы
ЃЌFгы дкSOCl2зїгУЯТЩњГЩGЃЌОнДЫЗжЮіНтД№ЁЃ
дкSOCl2зїгУЯТЩњГЩGЃЌОнДЫЗжЮіНтД№ЁЃ
(1) AЪЧ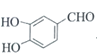 ЃЌXЮЊШЉРрЮяжЪЃЌЕУЕН
ЃЌXЮЊШЉРрЮяжЪЃЌЕУЕН ЃЌИљОнЬМдзгЪ§ФПЕФБфЛЏЃЌПЩжЊXЮЊМзШЉЃЌИљОнCЕФНсЙЙПЩжЊCжаКЌбѕЙйФмЭХЕФУћГЦЮЊУбМќКЭєЧЛљЃЛ
ЃЌИљОнЬМдзгЪ§ФПЕФБфЛЏЃЌПЩжЊXЮЊМзШЉЃЌИљОнCЕФНсЙЙПЩжЊCжаКЌбѕЙйФмЭХЕФУћГЦЮЊУбМќКЭєЧЛљЃЛ
(2) CЕФНсЙЙМђЪНЮЊ![]() ЃЌDЕФНсЙЙМђЪНЮЊ
ЃЌDЕФНсЙЙМђЪНЮЊ![]() ЃЌCжаЕФєЧЛљБЛBrдзгШЁДњЃЌдђЗДгІРраЭЮЊШЁДњЗДгІЃЛ
ЃЌCжаЕФєЧЛљБЛBrдзгШЁДњЃЌдђЗДгІРраЭЮЊШЁДњЗДгІЃЛ
(3)ИљОнЗжЮіЃЌЛЏКЯЮяFЕФНсЙЙМђЪНЮЊ![]() ЃЛ
ЃЛ
(4)BКЌгаШЉЛљЃЌОпгаЛЙдадЃЌПЩвдНЋаТжЦЕФЧтбѕЛЏЭЛЙдГЩбѕЛЏбЧЭЃЌBгыаТжЦЕФЧтбѕЛЏЭаќзЧвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2OЁ§+3H2OЃЛ
+Cu2OЁ§+3H2OЃЛ
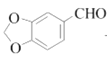
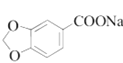
(5)гаЛњЮяYЪЧAЕФЭЌЗжвьЙЙЬхЃЌЗжзгЪНЮЊC7H6O3ЃЌТњзуЬѕМўЃКЂйФмгыШмвКЗЂЩњЯдЩЋЗДгІЃЌКЌгаЗгєЧЛљКЭБНЛЗЃЌЂк
![]() гызуСПН№ЪєNaЗДгІЩњГЩ
гызуСПН№ЪєNaЗДгІЩњГЩ![]() ЃЌПЩвдКЌгаєЧЛљЛђєШЛљЃЌЧвЗжзгжаКЌгаєЧЛљЛђєШЛљЙВ2ИіЃЌЂлНсЙЙжаКЌЁА
ЃЌПЩвдКЌгаєЧЛљЛђєШЛљЃЌЧвЗжзгжаКЌгаєЧЛљЛђєШЛљЙВ2ИіЃЌЂлНсЙЙжаКЌЁА![]() ЁБЃЌПЩвдгаШЉЛљЛђєШЛљЕФНсЙЙЃЌШєYЗжзгНсЙЙгЩСНИіЗгєЧЛљКЭвЛИіШЉЛљгыБНЛЗЯрСЌЃЌдђга5жжНсЙЙЃЌШєYЗжзгЕФНсЙЙгЩвЛИіЗгєЧЛљКЭвЛИієШЛљгыБНЛЗЯрСЌЃЌШЁДњЛљгаСкЃЌМфЃЌЖдЕФЮЛжУЃЌга3жжЃЌдђYЕФНсЙЙЙВга8жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЧвЗхУцЛ§БШЮЊ
ЁБЃЌПЩвдгаШЉЛљЛђєШЛљЕФНсЙЙЃЌШєYЗжзгНсЙЙгЩСНИіЗгєЧЛљКЭвЛИіШЉЛљгыБНЛЗЯрСЌЃЌдђга5жжНсЙЙЃЌШєYЗжзгЕФНсЙЙгЩвЛИіЗгєЧЛљКЭвЛИієШЛљгыБНЛЗЯрСЌЃЌШЁДњЛљгаСкЃЌМфЃЌЖдЕФЮЛжУЃЌга3жжЃЌдђYЕФНсЙЙЙВга8жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЧвЗхУцЛ§БШЮЊ![]() ЕФЮяжЪЮЊ
ЕФЮяжЪЮЊ

![]() жаЕФШЮвтвЛжжЃЛ
жаЕФШЮвтвЛжжЃЛ
(6)вд![]() ЮЊЦ№ЪМдСЯжЦБИ
ЮЊЦ№ЪМдСЯжЦБИ![]() ЕФКЯГЩЯпТЗЮЊ
ЕФКЯГЩЯпТЗЮЊ ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФЪ§жЕЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.12gН№ИеЪЏКЭЪЏФЋЕФЛьКЯЮяжаЃЌЬМдзгЪ§ЮЊNA
B.2Fe2++2H++3H2O2=2Fe3++O2Ёќ+4H2OЃЌдђУПЩњГЩ1 mol O2зЊвЦЕчзгЪ§ЮЊ2NA
C.вбжЊH3PO2ЃЋOHЃЈзуСПЃЉ= ![]() +H2OЃЌЫЕУї1 mol H3PO2ЕчРыГіH+Ъ§ЮЊNA
+H2OЃЌЫЕУї1 mol H3PO2ЕчРыГіH+Ъ§ЮЊNA
D.БъзМзДПіЯТЃЌ11.2 LввЭщКЭБНЕФЛьКЯЮяжаC-HЪ§ФПЮЊ 3NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЈЙ§ХХБЅКЭЪГбЮЫЎЃЌгУДѓЪдЙмЪеМЏЬхЛ§БШЮЊ1ЁУ1ЕФМзЭщКЭТШЦјЛьКЯЦјЃЈШчЭМЃЉЃЌЧПЙтееЩфЯТЗЂЩњЗДгІЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
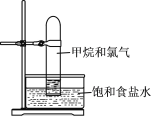
A.ЪдЙмжаЦјЬхбеЩЋБфЧГ
B.ЪдЙмФквКУцТ§Т§ЩЯЩ§
C.ЫЎВлжаЕФвКЬхШмгаТШЛЏЧт
D.ЪдЙмФкБкЕФгЭЕЮЪЧДПОЛЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊдЊЫидкКЃбѓжаЕФбЛЗЃЌЪЧећИіКЃбѓЩњЬЌЯЕЭГЕФЛљДЁКЭЙиМќЁЃКЃбѓжаЮоЛњЕЊЕФбЛЗЙ§ГЬПЩШчЭМБэЪОЁЃ
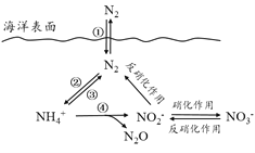
(1)КЃбѓжаЕФЕЊбЛЗЦ№ЪМгкЕЊЕФЙЬЖЈЃЌЦфжаЪєгкЙЬЕЊзїгУЕФвЛВНЪЧ__________(ЬюЭМжаЪ§зжађКХ)ЁЃ
(2)ЯТСаЙигкКЃбѓЕЊбЛЗЕФЫЕЗЈе§ШЗЕФЪЧ_______(ЬюзжФИађКХ)ЁЃ
a.КЃбѓжаДцдкгЮРыЬЌЕФЕЊ b.КЃбѓжаЕФЕЊбЛЗЦ№ЪМгкЕЊЕФбѕЛЏc.КЃбѓжаЕФЗДЯѕЛЏзїгУвЛЖЈгабѕЦјЕФВЮгыd.ЯђКЃбѓХХЗХКЌ![]() ЕФЗЯЫЎЛсгАЯьКЃбѓжа
ЕФЗЯЫЎЛсгАЯьКЃбѓжа![]() ЕФКЌСП
ЕФКЌСП
(3)габѕЪБЃЌдкЯѕЛЏЯИОњзїгУЯТЃЌ![]() ПЩЪЕЯжЙ§ГЬЂмЕФзЊЛЏЃЌНЋЙ§ГЬЂмЕФРызгЗНГЬЪНВЙГфЭъећЃК___
ПЩЪЕЯжЙ§ГЬЂмЕФзЊЛЏЃЌНЋЙ§ГЬЂмЕФРызгЗНГЬЪНВЙГфЭъећЃК___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕТЙњЛЏбЇМвF.HaberРћгУN2КЭH2дкДпЛЏМСБэУцКЯГЩАБЦјЖјЛёЕУХЕБДЖћНБЃЌИУЗДгІЕФЮЂЙлРњГЬМАФмСПБфЛЏЕФЪОвтЭМШчЯТЃЌгУ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЗжБ№БэЪОN2ЁЂH2ЁЂNH3ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
ЗжБ№БэЪОN2ЁЂH2ЁЂNH3ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
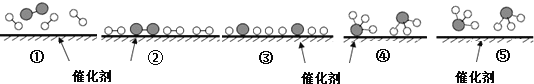
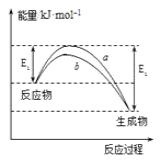
A. КЯГЩАБЗДгІжаЃЌЗДгІЮяЖЯМќЮќЪеФмСПДѓгкЩњГЩЮяаЮГЩаТМќЪЭЗХЕФФмСП
B. ДпЛЏМСдкЮќИНN2ЁЂH2ЪБЃЌДпЛЏМСгыЦјЬхжЎМфЕФзїгУСІЮЊЛЏбЇМќ
C. дкИУЙ§ГЬжаЃЌN2ЁЂH2ЖЯМќаЮГЩNдзгКЭHдзг
D. ЪЙгУДпЛЏМСЃЌКЯГЩАБЗДгІЗХГіЕФШШСПМѕЩй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂWОљЮЊЖЬжмЦкдЊЫиЃЌЫќУЧдкдЊЫижмЦкБэжаЕФЯрЖдЮЛжУШчЭМЫљЪОЁЃШєZдзгЕФзюЭтВуЕчзгЪ§ЪЧЕквЛВуЕчзгЪ§ЕФ3БЖЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ

A.XЕФзюГЃМћЦјЬЌЧтЛЏЮяЕФЫЎШмвКЯдЫсад
B.ZЕФЕЅжЪгыЧтЦјЗДгІБШYЕЅжЪгыЧтЦјЗДгІОчСв
C.зюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЫсадWБШZЧП
D.XЕФдзгАыОЖаЁгкY
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЫсЖЁѕЅЪЧживЊЕФЛЏЙЄдСЯЁЃЪЕбщЪвгУввЫсЁЂЖЁДМдкХЈСђЫсзїДпЛЏМСЁЂМгШШЬѕМўЯТжЦБИввЫсЖЁѕЅЕФзАжУЪОвтЭМ(МгШШКЭМаГжзАжУвбЪЁТд)КЭгаЙиаХЯЂШчЯТЃК
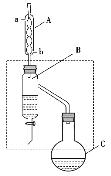
ввЫс | е§ЖЁДМ | ввЫсЖЁѕЅ | |
ШлЕу/Ёц | 16.6 | -89.5 | -73.5 |
ЗаЕу/Ёц | 117.9 | 117 | 126.0 |
УмЖШ/gЁЄcm-3 | 1.1 | 0.80 | 0.88 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.МгШШвЛЖЮЪБМфКѓЃЌЗЂЯжЩеЦПCжаЭќМЧМгЗаЪЏЃЌПЩДђПЊЦПШћжБНгМгШыМДПЩ
B.зАжУBЕФзїгУЪЧВЛЖЯЗжРыГіввЫсЖЁѕЅЃЌЬсИпВњТЪ
C.зАжУAПЩвдзАХфеєСѓзАжУЕФРфФ§ЦїЃЌЧвРфФ§ЫЎгЩaПкНјЃЌbПкГі
D.ввЫсЖЁѕЅжаВаСєЕФввЫсКЭе§ЖЁДМПЩгУБЅКЭЬМЫсФЦШмвКГ§ШЅ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
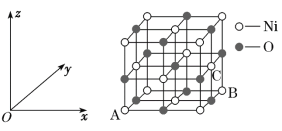
ЁОЬтФПЁПFeЁЂCoЁЂNiОљЮЊЕкЂјзхдЊЫиЃЌЫќУЧЕФЛЏКЯЮядкЩњВњЁЂЩњЛюжагазХЙуЗКЕФгІгУЁЃ
ЃЈ1ЃЉЛљЬЌFeдзгжаЃЌЕчзгЬюГфЕФФмСПзюИпЕФФмМЖЗћКХЮЊ__ЁЃ
ЃЈ2ЃЉдкПеЦјжаFeOЮШЖЈадаЁгкFe2O3ЃЌДгЕчзгХХВМЕФНЧЖШЗжЮіЃЌЦфжївЊдвђЪЧ__ЁЃ
ЃЈ3ЃЉЬњЧшЛЏМи{K3[Fe(CN)6])}ШмвКЪЧМьбщFe2+ГЃгУЕФЪдМСЁЃlmol[Fe(CN)6]3-КЌІвМќЕФЪ§ФПЮЊ__ЁЃ
ЃЈ4ЃЉCo3+ЕФвЛжжХфРызг[Co(N3)(NH3)5]2+жаЃЌCo3+ЕФХфЮЛЪ§ЪЧ__ЁЃХфЬхN3-жааФдзгЕФдгЛЏРраЭЮЊ__ЁЃCoOЕФШлЕуЪЧ1935ЁцЃЌCoSЕФШлЕуЪЧ1135ЁцЃЌЪдЗжЮіCoOЕФШлЕуНЯИпЕФдвђ__ЁЃ
ЃЈ5ЃЉNiOЕФОЇАћНсЙЙШчЭМЫљЪОЃЌЦфжадзгзјБъВЮЪ§AЮЊ(0ЃЌ0ЃЌ0)ЃЌBЮЊ(1ЃЌ1ЃЌ0)ЃЌдђCдзгзјБъВЮЪ§ЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђКЌШмжЪamol NaAlO2ЁЂamol Na2CO3ЕФЛьКЯШмвКжаМгШыbmolбЮЫсЃЌГфЗжЗДгІЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
A.ЕБaЁнbЪБЃЌ![]() +H++H2OЃНAl(OH)3Ё§
+H++H2OЃНAl(OH)3Ё§
B.ЕБ5aЃН2bЪБЃЌ5H++2![]() +H2O+2
+H2O+2![]() ЃНCO2Ёќ+
ЃНCO2Ёќ+![]() +2Al(OH)3Ё§
+2Al(OH)3Ё§
C.ЕБbЃН4aЪБЃЌГСЕэжЪСПЮЊ26ag
D.ЕБbЃН4.5aЪБЃЌШмвКжаAl3+гыAl(OH)3ЮяжЪЕФСПжЎБШЮЊ1ЁУ1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com