
【题目】德国化学家F.Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
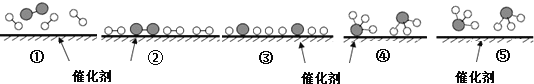
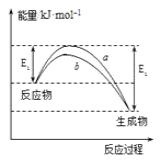
A. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
B. 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C. 在该过程中,N2、H2断键形成N原子和H原子
D. 使用催化剂,合成氨反应放出的热量减少
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④B. ③⑤⑥⑦⑧C. ③④⑤⑥⑦⑧D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用CH3CH2CH2Cl制取1,2—丙二醇,按正确的合成路线依次发生的反应所属类型应是 ( )
A. ①④③B. ③④①C. ③①④D. ①⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,B是非金属性最强的元素,A分别与 B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子,乙常温下为液态化合物, C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙 → 甲+C的化学反应方程式___________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:① 甲与丙以及乙与丙均能够发生反应,
② 甲、丙都是无色、有刺激性气味的物质。据此,请回答下列问题:写出上述第四种元素在周期表中第_________ 周期第_________ 族;写出 C+丙 → 乙+丁 的化学反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属电化学腐蚀的说法正确的是( )
A. 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B. 牺牲阳极的阴极保护法中被保护的金属应做负极
C. 外加电流阴极保护法中被保护的金属应与电源的负极相连
D. 析氢腐蚀比吸氧腐蚀普遍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv 的叙述错误的是
Lv 的叙述错误的是
A. 原子序数 116B. 中子数 177
C. 核外电子数 116D. 核电荷数 293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:
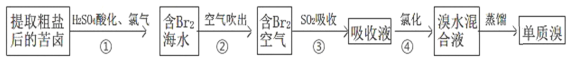
其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为____________mol。
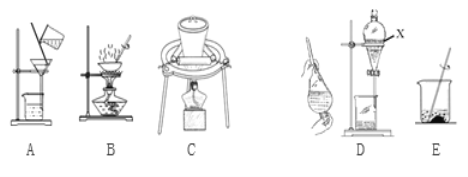
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列___________________________(填写编号)
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:

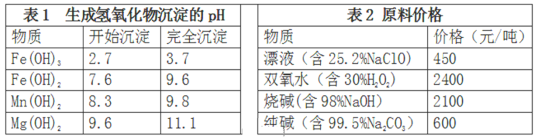
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:_____________________________________;
步骤②的反应方程式为:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com