
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
【答案】A
【解析】
实验1加入硝酸银生成白色沉淀,说明含有Cl-、CO32-、SO42-等离子中的至少一种;实验2加足量NaOH溶液并加热,收集到标准状况下的气体1.12L,说明含有0.5molNH4+;实验3加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量,第一次称量读数为6.27g,第二次称量读数为2.33g,则说明含有CO32-、SO42-,则一定不存在Mg2+、Ba2+,且n(SO42-)=![]() =0.01mol,n(CO32-)=
=0.01mol,n(CO32-)=![]() =0.02mol,结合电荷守恒分析解答。
=0.02mol,结合电荷守恒分析解答。
根据以上分析,溶液中一定含有0.02mol CO32-、0.01mol SO42-和0.5molNH4+;一定没有Mg2+、Ba2+;溶液显电中性,根据电荷守恒,溶液中一定存在K+,可能存在Cl-。
A.溶液中一定含有的阳离子是K+、NH4+,故A正确;
B.不能确定是否含有氯离子,故B错误;
C.溶液中一定存在K+,可能存在Cl-,故C错误;
D.向实验3所得沉淀中加入盐酸时,碳酸钡被盐酸溶解,反应的离子方程式为BaCO3+2H+=H2O+CO2↑+Ba2+,故D错误;
答案选A。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( )
A.①②③④
B.④①②③
C.④②①②③
D.①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的分子式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成18电子分子,分子式为_________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中酸性明显不同于其他三种酸的是_______(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时, B能使湿润的红色石蕊试纸变蓝。下列说法中不正确的是
![]()
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家F.Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
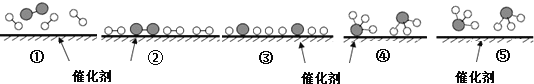
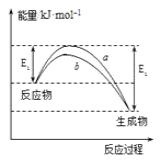
A. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
B. 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C. 在该过程中,N2、H2断键形成N原子和H原子
D. 使用催化剂,合成氨反应放出的热量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
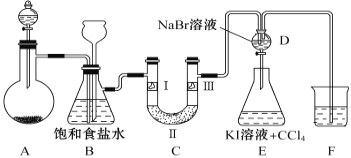
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式_______。
(2)Li2Ti5O15中过氧键的数目为4,其中Ti的化合价为______。
(3)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe2+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时_____(填“有”或“无”)Mg3(PO4)2沉淀生成。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-2、1.0×10-2。
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_________。
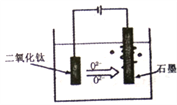
(5)TiO2·xH2O加热制得的粗TiO2是电解法生产金属钛的一种较先进的方法,电解液为某种可传导02-离子的熔融盐,原理如图所示,则其阴极电极反应为:_______,电解过程中阳极电极上会有气体生成,该气体可能含有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
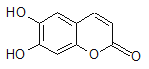
A、2 mol Br2 2 mol NaOH
B、2 mol Br2 3 mol NaOH
C、3 mol Br2 4 mol NaOH
D、4 mol Br2 4 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com