
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式_______。
(2)Li2Ti5O15中过氧键的数目为4,其中Ti的化合价为______。
(3)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe2+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时_____(填“有”或“无”)Mg3(PO4)2沉淀生成。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-2、1.0×10-2。
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_________。
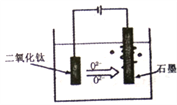
(5)TiO2·xH2O加热制得的粗TiO2是电解法生产金属钛的一种较先进的方法,电解液为某种可传导02-离子的熔融盐,原理如图所示,则其阴极电极反应为:_______,电解过程中阳极电极上会有气体生成,该气体可能含有____________。
【答案】 FeTiO3+ 4H++4Cl = Fe2++ TiOCl42 + 2H2O +4 无 2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑ TiO2+4e-=Ti+2O2- O2、CO、CO2
2LiFePO4+ H2O↑+ 3CO2↑ TiO2+4e-=Ti+2O2- O2、CO、CO2
【解析】(1)“酸浸”后,钛主要以TiOCl42-形式存在,相应反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,故答案为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O;
(2)Li2Ti5O15中Li的化合价为+1,有4个过氧键,说明有8个O原子的化合价为-1,7个O原子的化合价为-2,由化合价的代数和为0可知,,Ti元素的化合价之和为20,所以Ti的化合价为+4,故答案为:+4。
(3)Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,由Ksp(FePO4),可知![]() ,
,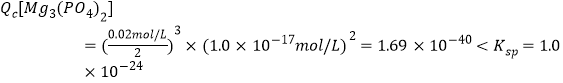
故没有沉淀生成。
(4)高温煅烧②”中由FePO4制备LiFePO4的化学方程式为2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑
2LiFePO4+ H2O↑+ 3CO2↑
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO、CO2等,故答案为:TiO2+4e-=Ti+2O2-;O2、CO、CO2。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是

A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属电化学腐蚀的说法正确的是( )
A. 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B. 牺牲阳极的阴极保护法中被保护的金属应做负极
C. 外加电流阴极保护法中被保护的金属应与电源的负极相连
D. 析氢腐蚀比吸氧腐蚀普遍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2)]是分析化学中的重要试剂,在隔绝空气加热至500℃时能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。某化学小组选用下图所示装置进行实验(夹持装置略),探究此反应产物。

(1)甲同学根据可能生成的气体产物,设计下列实验:
操作步骤 | 实验现象 | 结论或解释 |
①按______________的顺序组装仪器并进行实验 | ②___________ | 气体产物中既有H2O ,也有NH3 |
③按A、C、D、E的顺序组装仪器并进行实验,其中装置C的作用是____________ | C中无明显现象,D中生成白色沉淀 | ④D中发生反应的离子方程式为___________ |
(2)乙同学称取14.20g硫酸亚铁铵固体,隔绝空气加热至500℃ 时使其完全分解,冷却后称得固体质量为4.00g,则所得固体产物的化学式为_____。(硫酸亚铁铵的摩尔质量为284g·mol-1)
(3)实验证明:(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2生成,写出硫酸亚铁铵在隔绝空气的条件下加热至500℃时的分解反应方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv 的叙述错误的是
Lv 的叙述错误的是
A. 原子序数 116B. 中子数 177
C. 核外电子数 116D. 核电荷数 293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________ 与盐酸反应的速度最慢。实验结论为:_____________________________。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________。
Ⅱ. 利用下图装置可验证同主族元素非金属性的变化规律。
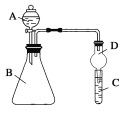
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,分别位于不同的周期。已知X和Y原子最外层电子数相同,Z原子次外层只有2个电子,X和Z可以形成离子化合物X2Y,Y和Z可以形成共价化合物Y2Z
(1)写出X、Y、Z三种元素的元素符号:X是____,Y是_____,Z是_____ ;
(2)X2Z的电子式_________, Y2Z的电子式________;
(3)X2Z和 Y2Z反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
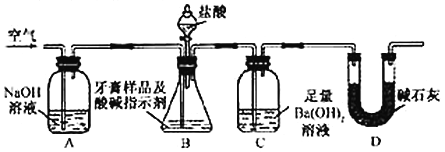
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________。
(4)C中反应生成沉淀的离子方程式是__________________。
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com