
【题目】实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是

A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
【答案】C
【解析】根据实验目的和装置图,实验原理为:样品与盐酸反应产生的CO2用足量Ba(OH)2溶液吸收,通过测量装置③中产生沉淀的质量计算纯碱的纯度。A,为了排除装置中含有CO2的空气对CO2测量的影响,滴入盐酸前,应将装置中含有CO2的空气排尽,A项正确;B,装置①中NaOH溶液的作用是吸收通入的空气中的CO2,防止空气中CO2进入装置③中,装置④的作用是防止外界空气中的CO2进入装置③中,B项正确;C,由于盐酸具有挥发性,反应产生的CO2中混有HCl,若在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶,HCl与NaHCO3反应产生CO2,使得测得的CO2偏大,测得纯碱的纯度偏大,C项错误;D,为了保证测量的CO2的准确性,反应结束,应继续通入除去CO2的空气将滞留在装置②中CO2全部转移到装置③中,D项正确;答案选C。


科目:高中化学 来源: 题型:
【题目】化学反应经常伴随着颜色变化。下列有关反应的颜色变化正确的是
A. 苯酚遇三氯化铁溶液变血红色
B. 淀粉溶液遇碘酸钾变蓝色
C. 植物油遇溴水变黄色
D. 氧化铜遇热的乙醇变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族B.第六周期第ⅡA族
C.第八周期第ⅠA族D.第七周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
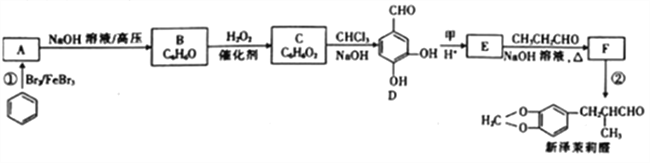
已知:①RCHO+R'CH2CHO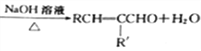
②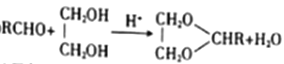
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备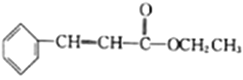 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)加入过量BaCl2目的是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解(______)
B.天平的砝码已锈蚀(______)
C.定容摇匀时,液面下降又加水(______)
D.定容时俯视刻度线(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
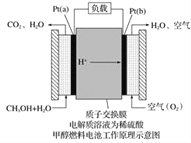
请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用12molL﹣1浓盐酸和蒸馏水配制480mL物质的量浓度为0.30molL﹣1的稀盐酸.
(1)该学生需要量取________mL上述浓盐酸进行配制.
(2)配制过程中正确的操作顺序是(字母表示,每个字母只能用一次)________;
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”、“无影响”).
A.用量筒量取浓盐酸时俯视观察凹液面________
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水________
C.稀释浓盐酸时,未冷却到室温即转移到容量瓶中________
D.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中________
E.容量瓶洗涤干净后未干燥________
(4)若在标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则此溶液中HCl物质的量浓度为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com