
【题目】用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( )
A.①②③④
B.④①②③
C.④②①②③
D.①③②④
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列一定属于放热反应的是( )
A. 不需要加热就能发生的反应
B. 拆开反应物所有化学键吸收的能量小于生成物化学键形成时释放的能量
C. 反应物总能量小于生成物总能量
D. NaOH固体溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液能用来区分SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③溴水 ④酸性高锰酸钾溶液 ⑤品红溶液
A. ③⑤ B. ②③⑤ C. ②③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是

A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO,和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式_____________。
(2) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________。
② 曲线c对应NH3与NO的物质的量之比是______。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④B. ③⑤⑥⑦⑧C. ③④⑤⑥⑦⑧D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示为含同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应水化物,则a不可能是(已知CH4高温时可发生分解生成C、H2)

①F2 ②N2 ③C ④S
A. 只有①B. ②和④C. ③和④D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________ 与盐酸反应的速度最慢。实验结论为:_____________________________。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________。
Ⅱ. 利用下图装置可验证同主族元素非金属性的变化规律。
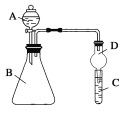
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_________溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com