
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A.X的最常见气态氢化物的水溶液显酸性
B.Z的单质与氢气反应比Y单质与氢气反应剧烈
C.最高价氧化物对应水化物的酸性W比Z强
D.X的原子半径小于Y
【答案】C
【解析】
若Z原子的最外层电子数是第一层电子数的3倍,则Z的最外层电子数为6,Z为硫(S);由图中元素的相对位置,可确定W为氯(Cl),Y为氧(O),X为氮(N),据此分析解答。
A.X(N)的最常见气态氢化物的水溶液为氨水,显碱性,A选项错误;
B.非金属性S<O,则Z(S)的单质与氢气反应没有Y(O)单质与氢气反应剧烈,B选项错误;
C.Cl和S为同周期元素,Cl在S的右边,所以非金属性Cl>S,从而得出最高价氧化物对应水化物的酸性W(Cl)比Z(S)强,C选项正确;
D.同周期元素,从左往右,原子半径依次减小,N在O的左边,所以X(N)的原子半径大于Y(O),D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
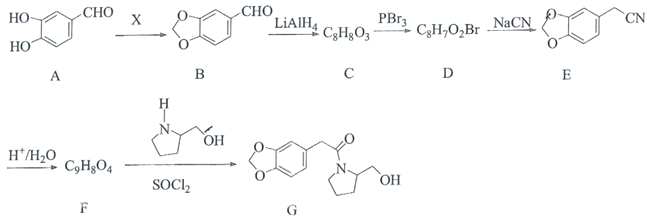
【题目】海南粗榧新碱具有抗肿瘤、抗炎等作用,其中间体G的合成线路如图:
已知:
①R-COOH+R′-NH2![]()
 +H2O;
+H2O;
②R-CN![]()
![]()
回答下列问题:
(1)X为醛类物质,其名称为________,C中含氧官能团的名称为________。
(2)C→D的反应类型为________。
(3)化合物F的结构简式为________。
(4)B与新制的氢氧化铜悬浊液反应的化学方程式为________。
(5)有机物Y是A的同分异构体,满足条件:①能与![]() 溶液发生显色反应,②
溶液发生显色反应,②![]() 与足量金属Na反应生成
与足量金属Na反应生成![]() ,③结构中含“
,③结构中含“![]() ”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为
”,Y共有________种,其中核磁共振氢谱显示为4组峰,且峰面积比为![]() 的物质为________(写出其中一种结构简式)。
的物质为________(写出其中一种结构简式)。
(6)设计以![]() 为起始原料制备
为起始原料制备![]() 的合成线路(无机试剂任选) ________。
的合成线路(无机试剂任选) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:
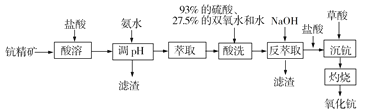
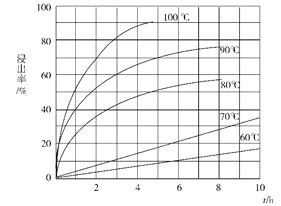
(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。
(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于105 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸钪“灼烧”的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
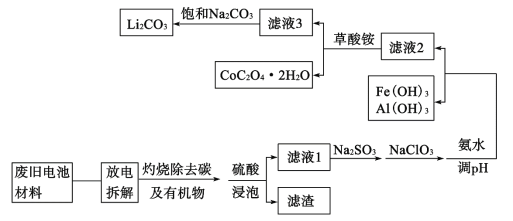
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
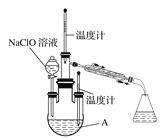
实验1:制备NaClO溶液。(已知:3NaClO![]() 2NaCl+NaClO3)
2NaCl+NaClO3)
(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为___________。

(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是__________ 。
实验2:制取水合肼。
(4)图中充分反应后,____________(填操作名称)A中溶液即可得到水合肼的粗产品。若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式 ________。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在 ________(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是 _________(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com