
【题目】下列物质分类正确的是( )
A.Na2O2、Fe3O4、CuO均为碱性氧化物
B.盐酸、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质
D.稀豆浆、硅酸、氯化铁溶液均为胶体
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列行为不符合实验安全要求的是( )
A.熄灭酒精灯时,用灯帽盖灭
B.点燃氢气前,先进行验纯操作
C.配制稀硫酸时,将浓硫酸缓慢倒入水中并不断搅拌
D.大量氯气泄漏时,迅速离开现场并尽量往低处去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
(1)写出下列仪器的名称:a.__________; b.___________;
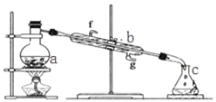
(2)实验过程中,需要通冷水,图中的进水方向是_______进(填图中字母);
(3)若利用装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77℃)的混合物,还缺少的仪器是_______;
II.现用NaOH固体配制0.1 mol/L NaOH溶液480mL,据此回答下列问题:
(4)配制氢氧化钠溶液需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______;
(5)实验时需要称量氢氧化钠_______g;
(6)配制0.1 mol/L NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有_______(填写字母)。
A.称量氢氧化钠固体时砝码放反了 B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液 E.定容时俯视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是

A. A与B的反应一定是化合反应
B. 离子半径:Z>X>Y>W
C. W、Y、Z均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
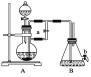
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是___________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为__________________。
(5)下图中________能较长时间看到Fe(OH)2白色沉淀。
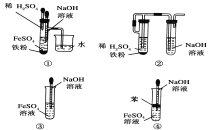
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
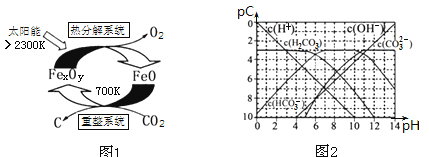
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板A、B分成甲、乙两室。标准状况下,在乙室充入8.4g N2,甲室充入8.8g H2和O2的混合气体。
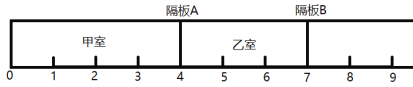
(1)甲室中H2与O2的质量比为_____________,甲室中原子个数约为 ____________个。
(2)维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P(甲):P(乙)=______________。
(3)用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“1998年中国十大科技成果”之一是合成一维纳米氮化镓。已知氮化镓中镓是第ⅢA族元素,则氮化镓的化学式可能为( )
A.GaNB.Ga2N3C.Ga3N2D.GaN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com