
(7分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
|
|
正极反应式: ,负极反应式: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu |
(7分,每空1分,装置图1分,第(3)小问3分) (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图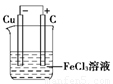 2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+; ②加入CuO调节溶液pH至3.2~4.7;
③过滤[除去Fe(OH)3]
【解析】(1)氯化铁能溶解单质铜,反应的方程式是2Fe3++Cu===2Fe2++Cu2+。
(2)由于原电池中负极失去电子,正极得到电子,因此根据反应式可知,负极是铜,正极可以是石墨等,而电解质溶液应该是氯化铁,装置图为(见答案)。其中电极反应式是正极:2Fe3++2e-===2Fe2+、负极:Cu-2e-===Cu2+。
(3)根据表中数据可知,沉淀亚铁离子的pH大于沉淀铜离子的pH,所以应该将溶液中的亚铁离子氧化生成铁离子,然后在调节pH将铁离子沉淀出来。即正确的做法是①通入足量氯气将Fe2+氧化成Fe3+; ②加入CuO调节溶液pH至3.2~4.7;③过滤[除去Fe(OH)3]。


科目:高中化学 来源: 题型:
用常见的金属及化合物的知识填空。
(1)过氧化钠可用于宇航员或潜水艇中氧气再生的来源,请分别写出宇航员呼出的水蒸
气和二氧化碳跟过氧化钠反应的化学方程式:
① ;②
(2)铝是一种日常生活中应用很广的重要金属。
①在酒精灯上加热未经打磨的铝箔,出现的现象是 。
②铝制炊具长时间烧煮碱性食物的过程中,铝的保护膜将被破坏。写出铝的保护膜与强碱发生化学反应的离子方程式 。
(3)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
①自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:
。
②向沸水中逐滴滴加饱和FeC13溶液,至液体呈透明的红褐色,形成该分散系的分散质粒子直径范围是 nm。
③电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeC13溶液与铜反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com