
用常见的金属及化合物的知识填空。
(1)过氧化钠可用于宇航员或潜水艇中氧气再生的来源,请分别写出宇航员呼出的水蒸
气和二氧化碳跟过氧化钠反应的化学方程式:
① ;②
(2)铝是一种日常生活中应用很广的重要金属。
①在酒精灯上加热未经打磨的铝箔,出现的现象是 。
②铝制炊具长时间烧煮碱性食物的过程中,铝的保护膜将被破坏。写出铝的保护膜与强碱发生化学反应的离子方程式 。
(3)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
①自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:
。
②向沸水中逐滴滴加饱和FeC13溶液,至液体呈透明的红褐色,形成该分散系的分散质粒子直径范围是 nm。
③电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeC13溶液与铜反应的离子方程式 。
科目:高中化学 来源: 题型:阅读理解
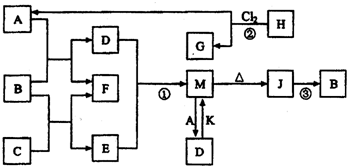 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为

| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
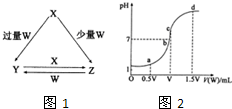 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:
(1)C、D组成的常见化合物,其水溶液呈碱性,原因是_____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式______________________________。
(2)D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式_____________。
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_____________。
(4)
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的_______极;B极的电极反应式是___________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省宣威市高三上学期期末考试理科化学部分 题型:填空题
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图18所示(部分产物及反应条件没有列出):

⑴ 写出框图中A转化为B的化学方程式: ,该反应属于 (填“吸热反应”或“放热反应”),引发该反应的操作是 。
⑵ 若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
。
⑶ 若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
① 将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是 (填字母)。
a.达到化学平衡时,2 v正(C) = 3 v逆(乙)
b.反应过程中,D单质的体积分数始终为50 %
c.达到化学平衡时,混合气体的密度减小
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
② 若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5 %。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为 ;达到平衡后,若向容器中按5︰1︰2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com