
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3)
B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2-3△H3)
D. △H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,互为同系物的是
A. CH3CH=CH2与CH3CH3B.  与
与 ![]()
C. CH3CH2OH 与CH2OHCH2OHD. C3H8和C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为__________。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__________ 。若烃B的相对分子质量比烃A小6,且B为最简单芳香族化合物,写出B与浓硝酸,浓硫酸混合共热的化学方程式__________
(3)如图:

①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水反应,消耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;
(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:

①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
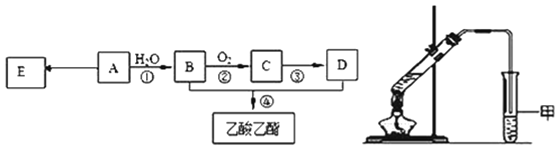
(1)0.1mol该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______任填一种直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_________;
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是______________________。
③乙醇与乙酸反应的化学方程式是:__________________, 浓硫酸的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为______(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。

①10min时,v(SO3)=_____。
②反应达到平衡时,SO2的转化率为______。
③下列情况能说明该反应达到化学平衡的是_____
A. v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A. 氯水中有下列平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液
A. ①和④ B. ①和② C. ①和③ D. ③和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com