
| A. | H2O2的电子式: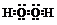 | |
| B. | 乙醇的结构式:C2H6O | |
| C. | 磷原子的结构示意图: | |
| D. | FeSO4 的电离方程式:FeSO4=Fe3++SO42ˉ |
分析 A.双氧水属于共价化合物,分子中含有2个O-H键和1个O-O键;
B.结构式中应该用短线代替所有的共用电子对;
C.P原子的核外电子总数为15,最外层含有5个电子;
D.硫酸亚铁在溶液中电离出亚铁离子和硫酸根离子.
解答 解:A.双氧水为共价化合物,分子中含有2个O-H键和1个O-O键,则H2O2的电子式为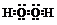 ,故A正确;
,故A正确;
B.C2H6O为分子式,乙醇的结构式为: ,故B错误;
,故B错误;
C.P原子的核电荷数=核外电子总数=15,最外层含有5个电子,其正确的原子结构示意图为: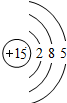 ,故C错误;
,故C错误;
D.FeSO4的电离方程式为:FeSO4=Fe2++SO42-,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及原子结构示意图、结构式、电子式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有②③ | C. | 只有①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为2NA | |
| B. | 标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA | |
| C. | 10L0.1mol•L-1的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2g丙烯中所含碳氢键数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com