
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(已知:NH4++OH-![]() NH3↑+H2O)
NH3↑+H2O)
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到0.08mol气体;
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?________(答是或否)
(2)由第二份进行的实验得知混合物中应含有_____(填离子符号),其物质的量浓度为______。
(3)由第三份进行的实验可知12.54g沉淀的成分为________。
(4)综合上述实验,你认为以下结论正确的是_________。
A.该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol
B.该混合液中一定有NH4+、CO32-、SO42-,可能含有K+、Cl-
C.该混合液中一定有NH4+、CO32-、SO42-,可能含有Mg2+、K+、Cl-
D.该混合液中一定有NH4+、SO42-,可能含有Mg2+、K+、Cl-
(5)我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4=K2SO4+I2+H2O
①配平该方程式,并且用单线桥法表示该方程式电子转移的方向和数目:________。
②该反应中氧化剂和还原剂的物质的量之比为_____________。
③如果反应中转移0.5mol电子,则生成I2的物质的量为_________。
【答案】否 NH4+ 0.8mol/L BaSO4、BaCO3 A 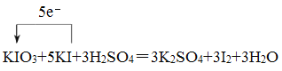 1:5 0.3mol
1:5 0.3mol
【解析】
第一份加入AgNO3溶液有沉淀产生,则一定含有Cl-、CO32-、SO42-中的一种;第二份加足量NaOH溶液加热后,收集到气体0.08mol,气体为氨气,则一定含NH4+;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,则沉淀为碳酸钡、硫酸钡,SO42-的物质的量为4.66g÷233g/mol=0.02mol,CO32-的物质的量为(12.54-4.66)g÷197g/mol=0.04mol,结合离子之间的反应及电荷守恒来解答。
第一份加入AgNO3溶液有沉淀产生,则一定含有Cl-、CO32-、SO42-中的一种;第二份加足量NaOH溶液加热后,收集到气体0.08mol,气体为氨气,则一定含NH4+;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,则一定含硫酸钡,SO42-的物质的量为4.66g÷233g/mol=0.02mol,CO32-的物质的量为(12.54-4.66)g÷197g/mol=0.04mol,含CO32-、SO42-,则一定不含Mg2+、Ba2+,阳离子电荷总量为0.08mol,CO32-、SO42-的电荷总量为0.02mol×2+0.04mol×2=0.12mol,由电荷守恒可知,一定含阳离子K+,综上所述,不能确定是否含有Cl-;则根据电荷守恒溶液中K+的物质的量≥0.12mol-0.08mol=0.04mol。
(1)根据以上分析可知由第一份进行的实验推断该混合物中不一定含有Cl-;
(2)根据以上分析可知由第二份进行的实验得知混合物中应含有NH4+,其物质的量浓度为0.08mol÷0.1L=0.8mol/L;
(3)根据以上分析可知由第三份进行的实验可知12.54g沉淀的成分为BaSO4、BaCO3;
(4)综合上述实验,该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol,答案选A。
(5)①反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,可知(KIO3):n(KI)=1:5,结合质量生成配平方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,用单线桥法表示该方程式电子转移的方向和数目为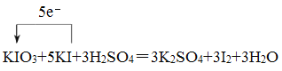 ;
;
②KIO3为氧化剂,KI为还原剂,由方程式可知氧化剂和还原剂的物质的量之比为1:5;
③在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.5mol电子,则生成I2的物质的量为0.3moL。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 1L0.1mol·L-1的醋酸溶液中含有氢离子数目为0.1NA
C. 标准状况下,2.24LCCl4含碳原子数目为0.1NA
D. 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNO2![]() RNH2;
RNH2;
②![]() +HOSO3H
+HOSO3H![]() +H2O;
+H2O;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。 以下是用苯作原料制备某些化合物的转化关系图:

(1)A是一种密度比水______ (填“小”或“大”)的无色液体;A转化为B的化学方程 式是______。
(2)在“![]() ”的所有反应中属于取代反应的是_________(填字母),属于加成反应的是________(填字母);用1H核磁共振谱可以证明化合 物D中有__________种处于不同化学环境的氢。
”的所有反应中属于取代反应的是_________(填字母),属于加成反应的是________(填字母);用1H核磁共振谱可以证明化合 物D中有__________种处于不同化学环境的氢。
(3) B 中 苯 环 上 的 二 氯 代 物 有 _____种 同 分 异 构 体 ; CH3NH2 的 所 有 原 子_____(填“可能”或“不可能”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A. 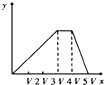 B.
B. 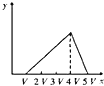
C. 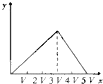 D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
B. 等浓度等体积的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
B. 已知BaSO4溶度积常数1.0×10-10,则BaSO4在水中溶解度为2.33×10-4g/100g水
C. Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度一定是![]() ×10-11mol·L-1
×10-11mol·L-1
D. 向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),溶液中的c(Mg2+)减小而Ksp(MgCO3) 不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析正确的是

A. 溶液中c(A2+)增大
B. B的电极反应:B→B2++2e-
C. y电极上有氢气产生,发生还原反应
D. 反应初期,x电极周围出现白色胶状沉淀,随后沉淀也不会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物性质的说法正确的是 ( )
A. 乙烯和甲烷都可以与氯气反应 B. 乙烯和聚乙烯都能使溴水褪色
C. 乙烯和苯都能使酸性高锰酸钾溶液褪色 D. 乙酸能与钠产生氢气,而乙醇不可以
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com